特邀博客作者 Richard I. Gregory 博士是哈佛医学院教授兼波士顿儿童医院干细胞项目首席研究者。目前,他的研究重点是癌症中的表观转录组,其最新发现包括鉴定 RNA 甲基转移酶 (MTases)、METTL3 和 METTL1 为各种癌症类型中的新癌基因。
—
细胞 RNA 经多种化学实体修饰。1最近,特定 RNA 化学修饰位点的全面定位已经开始界定表观转录组。2各个修饰发生在不同的编码性和/或非编码性 RNA 亚群上,影响其生物发生、稳定性、定位或功能,并代表转录后控制基因表达的一个重要但目前未被充分重视的方面。此外,负责某些 RNA 修饰的酶的基因突变、扩增和/或失调表达与儿童发育障碍和多种癌症有关。
界定全部 m7G RNA 甲基化组的转录组级方法
N7-甲基鸟苷 (m7G) 是原核生物、真核生物和一些古细菌中普遍存在的 tRNA 修饰,这种修饰发生在某些 tRNA 的可变环中核苷酸位置 G46 处。这种修饰有助于稳定 tRNA 的功能性构象,防止其降解3。
在波士顿儿童医院的 Gregory Laboratory,我们最近的研究已使用基于抗体和化学的方法,结合高通量互补性 DNA (cDNA) 测序,全面定位整个转录组的 m7G。我们开发了 m7G 甲基化 tRNA 免疫沉淀测序法 (m7G MeRIP-Seq) 和 tRNA 还原与剪切测序法 (TRAC-Seq),旨在小鼠胚胎干细胞 (mESC) 和人癌细胞系中按单核苷酸分辨率具体揭示 m7G tRNA 甲基化。4-6 这些全面调查揭示了在 tRNA 可变环区内部 RAGGU 序列基序处受修饰的 tRNA 亚群。
这些结果还表明,m7G 修饰主要限于 tRNA,这一结论得到相关方法的支持。7 然而,其他同期研究报告称,在某些信使 RNA (mRNA) 和初级 microRNA (pri-miRNA) 转录物中存在内部 m7G 修饰,不过这些研究结果存在争议且需要进一步研究。8-10
m7G 甲基转移酶 (MTase) 复合体:METTL1/WDR4
在哺乳动物中,m7 受 G46 甲基转移酶 1 (METTL1) 及其必需的辅助因子 — 含 WD 重复序列蛋白 4 (WDR4) 催化,后两者是此前在酵母中鉴定的 Trm8/Trm82 复合体的同源基因。11 最近的结构研究为 m7G MTase 复合体如何特异性结合和修饰其 tRNA 底物的特异性亚群提供了新的见解。12, 13 酵母复合体是热应激下生长所必需的,但在最佳条件下则非必需。14 然而,相比之下,METTL1 和 WDR4 是正常细胞周期进程和 mESC 分化所必需的,它们的突变或失调与人类疾病有关。4, 15, 16
METTL1/WDR4 MTase 复合体缺陷导致发育缺陷
位于人类染色体 21q22.3 的 WDR4 基因的种系突变导致一种迥异的小头畸形原始侏儒症,其特征是面部畸形、脑畸形和重度脑病伴有癫痫发作。15, 16 WDR4 也是一些唐氏综合征表型的候选基因,这些表型包括人类患者因染色体三体导致智力低下。17事实上,WDR4 是少数候选基因之一,其在小鼠中的过度表达会影响唐氏综合征模型中的学习和记忆。18同一基因簇的单体性也影响认知和海马可塑性,从而支持这样的结论:这个染色体区域内部某些基因的精确剂量对正常脑功能至关重要。19
有趣的是,mESC 中 METTL1 或 WDR4 的缺失会导致细胞分化缺陷,特别是神经谱系发育过程中的外胚层分化受损(图 1)。4 在机制上,核糖体分析 (Ribo-Seq) 确定了 METTL1 敲除 ESC 中细胞周期相关性 mRNA 和控制前脑形态的 mRNA 的翻译效率降低,并且这些 mRNA 富含需要 m7G 修饰的 tRNA 以进行翻译的密码子。4
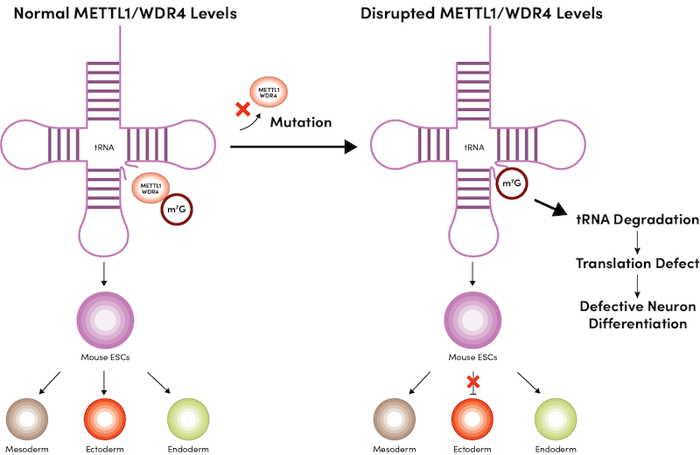
图 1:小鼠 mESC 中 METTL1 或 WDR4 的缺乏导致神经元分化缺陷。
总而言之, 有关 mESC 中 m7G tRNA 修饰的分子和细胞需求的研究结果为这些人类发育障碍的病因学提供了新见解。
METTL1/WDR4 MTase 复合体失调驱动癌症形成
我们将 METTL1 鉴定为一种有效的癌基因,它在许多人类癌症中有扩增和/或过度表达的现象。6 METTL1 缺陷在几种不同的癌症模型中强烈抑制癌细胞增殖、细胞周期进程和肿瘤生长。
相反,METTL1/WDR4 复合体过表达导致恶性转化,包括细胞增殖增加、细胞周期进程度加速、集落形成加强和体内肿瘤形成(图 2)。
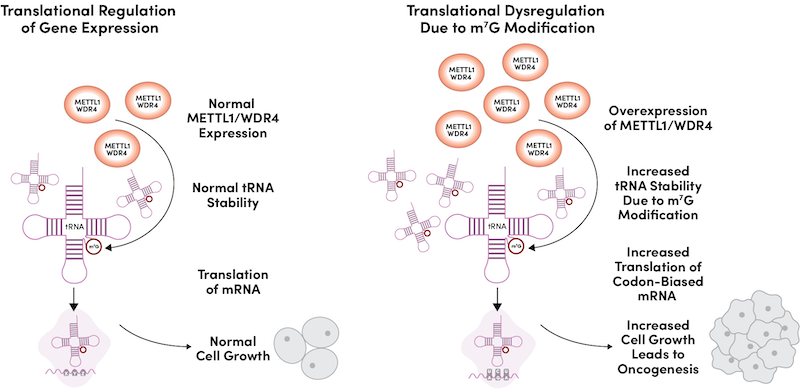 图 2:MTase 复合体表达升高导致起 tRNA 稳定性和丰度增加,引起细胞周期调节分子 mRNA 的翻译增加,从而导致高度化的细胞生长和肿瘤发生。
图 2:MTase 复合体表达升高导致起 tRNA 稳定性和丰度增加,引起细胞周期调节分子 mRNA 的翻译增加,从而导致高度化的细胞生长和肿瘤发生。
从机制上讲,MTase 复合体的表达升高导致 m7G 修饰的 tRNA 亚群的丰度升高,并导致 mRNA 亚群(尤其细胞周期调节因子)的翻译和蛋白质表达增加,这些 mRNA 富含为 m7G 修饰的 tRNA 所解码的密码子。6最近越来越多的研究强调了 METTL1/WDR4 致癌活性在许多不同癌症类型中的重要性20-22,这表明抑制这种 MTase 复合体可能带来一种新的、有前景的癌症治疗方法。
m7G tRNA 修饰:未来的治疗前景
如上文突显,m7G 修饰发生在 tRNA 亚群中,使修饰的 tRNA 稳定,且是正常 mRNA 翻译所必需的。METTL1/WDR4 MTase 复合体缺乏导致小鼠干细胞自我更新和神经元分化缺陷,并且是某些人类发育障碍的遗传因素所致。相反,m7G MTase 复合体过度激活则驱动肿瘤发生。在这两种情况下,功能性 tRNA 池的变化和随后的 mRNA“翻译组”重塑有可能造成我们所观察到的表型。
某些密码子在不同的 mRNA 亚群中过表达及因此对相应 tRNA 群体的差异性要求 — 一种最初在酵母应激反应调节中鉴定的名为密码子偏置翻译的现象 — 也意味着我们目前对遗传密码的理解过于简化。这表明某些 tRNA 修饰作用可能差异性影响某些基因亚群的 mRNA 翻译和蛋白质表达23。
深入了解 tRNA 表观转录组和 tRNA 损坏在人类疾病中的作用,可以为靶向转录后基因调控的新治疗方法打下基础。例如,考虑到 METTL1 在许多不同类型的癌症中有致癌性及基因敲减或敲除在各种小鼠模型中抑制肿瘤生长,用小分子药物抑制这种酶可能代表一种潜在的癌症治疗新策略。N6-甲基腺苷 (m6A) 转移酶 METTL3 的化学抑制剂在急性髓性白血病 (AML) 小鼠模型中有显著抗癌功效,这进一步支持了实施表观转录组治疗癌症的前景。24, 25 此外,除了在促进癌细胞生长方面的作用,METTL1 还在小鼠肝内胆管癌 (ICC) 模型中影响肿瘤微环境和对免疫检查点抑制剂(抗 PD-1 抗体)的治疗反应。26现在需要识别 METTL1 的特异性化学抑制剂,以开发有效的癌症治疗新方法。
m7G 是 150 多种不同的已知 RNA 修饰之一,而且人们探索表观转录组的兴趣正迅速增加。实现精确定位各种修饰作用的新方法和新试剂对这些研究工作取得进展至关重要。
其他资源:
-
探索 RNA 调节机制,包括 RNA 修饰。
-
请在加州大学欧文分校微生物学和分子遗传学助理教授 Gina Lee 博士的博客文章“M6A:细胞隐藏的基因调节信号”了解 m6A——真核生物中最丰富的 mRNA 修饰。
选择参考文献:
-
Boccaletto P, Stefaniak F, Ray A et al. MODOMICS: a database of RNA modification pathways. 2021 update. Nucleic Acids Res. 2022;50(D1):D231-D235. doi:10.1093/nar/gkab1083
-
Moshitch-Moshkovitz S, Dominissini D, Rechavi G. The epitranscriptome toolbox. Cell. 2022;185(5):764-776. doi:10.1016/j.cell.2022.02.007
-
Alexandrov A, Chernyakov I, Gu W, 等人Rapid tRNA decay can result from lack of nonessential modifications. Mol Cell. 2006;21(1):87-96. doi:10.1016/j.molcel.2005.10.036
-
Lin S, Liu Q, Lelyveld VS, Choe J, Szostak JW, Gregory RI. Mettl1/Wdr4-Mediated m7G tRNA Methylome Is Required for Normal mRNA Translation and Embryonic Stem Cell Self-Renewal and Differentiation. Mol Cell. 2018;71(2):244-255.e5. doi:10.1016/j.molcel.2018.06.001
-
Lin S, Liu Q, Jiang YZ, Gregory RI. Nucleotide resolution profiling of m7G tRNA modification by TRAC-Seq. Nat Protoc. 2019;14(11):3220-3242. doi:10.1038/s41596-019-0226-7
- Orellana EA, Liu Q, Yankova E 等人 METTL1-mediated m7G modification of Arg-TCT tRNA drives oncogenic transformation. Mol Cell. 2021;81(16):3323-3338.e14. doi:10.1016/j.molcel.2021.06.031
-
Marchand V, Ayadi L, Bourguignon-Igel V, Helm M, Motorin Y. AlkAniline-Seq: A Highly Sensitive and Specific Method for Simultaneous Mapping of 7-Methyl-guanosine (m7G) and 3-Methyl-cytosine (m3C) in RNAs by High-Throughput Sequencing. Methods Mol Biol. 2021;2298:77-95. doi:10.1007/978-1-0716-1374-0_5
-
Zhang LS, Liu C, Ma H, et al. Transcriptome-wide Mapping of Internal N7-Methylguanosine Methylome in Mammalian mRNA. Mol Cell. 2019;74(6):1304-1316.e8. doi:10.1016/j.molcel.2019.03.036
-
Pandolfini L, Barbieri I, Bannister AJ, et al. METTL1 Promotes let-7 MicroRNA Processing via m7G Methylation. Mol Cell. 2019;74(6):1278-1290.e9. doi:10.1016/j.molcel.2019.03.040
- Vinther J. No Evidence for N7-Methylation of Guanosine (m7G) in Human let-7e. Mol Cell. 2020;79(2):199-200. doi:10.1016/j.molcel.2020.05.022
- Alexandrov A, Martzen MR, Phizicky EM. Two proteins that form a complex are required for 7-methylguanosine modification of yeast tRNA. RNA. 2002;8(10):1253-1266. doi:10.1017/s1355838202024019
- Ruiz-Arroyo VM, Raj R, Babu K, Onolbaatar O, Roberts PH, Nam Y. Structures and mechanisms of tRNA methylation by METTL1-WDR4 [在线发表先于见刊,2023 年 1 月 4 日]. Nature. 2023;10.1038/s41586-022-05565-5. doi:10.1038/s41586-022-05565-5
- Li J, Wang L, Hahn Q, et al. Structural basis of regulated m7G tRNA modification by METTL1-WDR4 [在线发表先于见刊,2023 年 1 月 4 日]. Nature. 2023;10.1038/s41586-022-05566-4. doi:10.1038/s41586-022-05566-4
- Alexandrov A, Grayhack EJ, Phizicky EM. tRNA m7G methyltransferase Trm8p/Trm82p: evidence linking activity to a growth phenotype and implicating Trm82p in maintaining levels of active Trm8p. RNA. 2005;11(5):821-830. doi:10.1261/rna.2030705
- Filonava L, Torres AG, Ribas de Pouplana L. A novel cause for primordial dwarfism revealed: defective tRNA modification. Genome Biol. 2015;16:216. Published 2015 Oct 1. doi:10.1186/s13059-015-0786-y
- Shaheen R, Abdel-Salam GM, Guy MP 等人 Mutation in WDR4 impairs tRNA m(7)G46 methylation and causes a distinct form of microcephalic primordial dwarfism. Genome Biol. 2015;16:210. 发表日期:2015 年 9 月 28 日. doi:10.1186/s13059-015-0779-x
- Michaud J, Kudoh J, Berry A 等人 Isolation and characterization of a human chromosome 21q22.3 gene (WDR4) and its mouse homologue that code for a WD-repeat protein. Genomics. 2000;68(1):71-79. doi:10.1006/geno.2000.6258
- Pereira PL, Magnol L, Sahún I 等人A new mouse model for the trisomy of the Abcg1-U2af1 region reveals the complexity of the combinatorial genetic code of down syndrome. Hum Mol Genet. 2009;18(24):4756-4769. doi:10.1093/hmg/ddp438
- Sahún I, Marechal D, Pereira PL 等人 Cognition and hippocampal plasticity in the mouse is altered by monosomy of a genomic region implicated in Down syndrome. Genetics. 2014;197(3):899-912. doi:10.1534/genetics.114.165241
- Dai Z, Liu H, Liao J 等人 N7-Methylguanosine tRNA modification enhances oncogenic mRNA translation and promotes intrahepatic cholangiocarcinoma progression. Mol Cell. 2021;81(16):3339-3355.e8. doi:10.1016/j.molcel.2021.07.003
- Ma J, Han H, Huang Y 等人 METTL1/WDR4-mediated m7G tRNA modifications and m7G codon usage promote mRNA translation and lung cancer progression. Mol Ther. 2021;29(12):3422-3435. doi:10.1016/j.ymthe.2021.08.005
- Han H, Yang C, Ma J 等人 N7-methylguanosine tRNA modification promotes esophageal squamous cell carcinoma tumorigenesis via the RPTOR/ULK1/autophagy axis. Nat Commun. 2022;13(1):1478. 发表日期:2022 年 3 月 18 日. doi:10.1038/s41467-022-29125-7
- Dedon PC, Begley TJ. Dysfunctional tRNA reprogramming and codon-biased translation in cancer. Trends Mol Med. 2022;28(11):964-978. doi:10.1016/j.molmed.2022.09.007
-
Yankova E, Blackaby W, Albertella M 等人Small-molecule inhibition of METTL3 as a strategy against myeloid leukaemia. Nature. 2021;593(7860):597-601. doi:10.1038/s41586-021-03536-w
-
Li J, Gregory RI. Mining for METTL3 inhibitors to suppress cancer. Nat Struct Mol Biol. 2021;28(6):460-462. doi:10.1038/s41594-021-00606-5
-
Liu H, Zeng X, Ren X, et al. Targeting tumour-intrinsic N7-methylguanosine tRNA modification inhibits MDSC recruitment and improves anti-PD-1 efficacy [在线发表先于见刊,2022 年 10 月 25 日]. Gut. 2022;gutjnl-2022-327230. doi:10.1136/gutjnl-2022-327230
披露:Richard I. Gregory 是 Redona Therapeutics 的联合创始人、科学顾问委员会成员和股东,并获得报酬以参加 Cell Signaling Technology 的“关键意见领袖”活动。Gregory Lab 从 Sanofi、Astellas 和 Ono 接受或已接受研究资助。



 沪公网安备31011502018823号
沪公网安备31011502018823号