帕金森病 (PD) 是一种持续性的进行性神经退行性疾病,其特征是错误折叠的 α-突触核蛋白聚集,在黑质中的多巴胺能神经元内形成路易体。这种堆积最终会导致神经元破坏。1,2
除可见症状外,研究发现帕金森病还会破坏多条细胞内通路,特别是与自噬和线粒体自噬相关的通路,导致运动功能多年逐渐衰退。全球有超过 1000 万人受到影响,美国每年的医疗保健费用超过 520 亿美元,因此,对早期精准诊断的需求比以往任何时候都更加紧迫。3,4
|
探索帕金森病抗体小包装组合,包含本博客中提到的许多标记物的抗体试剂: |
|
目前帕金森病尚无明确诊断方法。神经科医生只能依赖患者病史、运动症状、影像学表现和治疗反应进行判断。但如果我们能够在主要症状出现之前检测出这种疾病呢?这时蛋白质和遗传生物标记物就至关重要。它们有助于在疾病进展早期识别可靠的生物信号,并揭示帕金森病病因的细胞和分子机制。
<Jump to the product list at the end of this blog>
路易体相关蛋白
路易体是错误折叠的蛋白质的聚集体,它会破坏多种神经元过程,包括突触释放和线粒体功能。这种功能障碍的核心是与帕金森病相关的关键蛋白——α-突触核蛋白。
#1:α-Synuclein
α-突触核蛋白是一种参与囊泡运输的突触前蛋白。然而,当折叠错误时,它会形成帕金森病特征性病理标志——路易体。这种蛋白已成为识别帕金森病和评估潜在治疗方法的重要生物标记物。
2023 年,Michael J Fox 基金会公开了 α-突触核蛋白种子扩增试验,该试验通过分析脑脊液样本检测错误折叠的 α-突触核蛋白。令人瞩目的是,该检测技术在 87% 的患者出现运动症状前就准确识别出帕金森病,引发了针对 α-突触核蛋白的单克隆抗体疗法研究的热潮,目前多家公司正在探索相关治疗方案。5
#2:磷酸化 α-突触核蛋白
突触核蛋白是帕金森病中研究最多的蛋白质之一,这是有充分理由的。路易体中发现的 α-突触核蛋白超过 90% 被磷酸化,使得磷酸化 α-突触核蛋白成为帕金森病的有力指标。由于这种蛋白可在脑脊液中检测到,研究人员正在积极研究它作为帕金森病潜在生物标记物和诊断工具的可能性。6
|
浏览用于评估 α-突触核蛋白磷酸化状态的抗体产品: • PhosphoPlus® α-Synuclein (Ser129) Antibody Duet #29087 |
|
#3:多巴脱羧酶 (DDC)
多巴脱羧酶 (DDC) 是一种同型二聚体酶,可催化 L-多巴脱羧生成多巴胺。近期研究发现帕金森病患者脑脊液和尿液中 DDC 水平升高,且该指标可区分帕金森病与阿尔茨海默病患者。7 因此,DDC 有望成为鉴别帕金森病与其他神经退行性疾病的潜在生物标记物。
#4:葡萄糖脑苷脂酶 (GCase/GBA)
GCase 最初与戈谢病相关,因其与路易体形成的密切关联而受到帕金森病研究的关注。编码 GCase 的 GBA 基因突变被认为是帕金森病和路易体痴呆的重要风险因素。
使用 GCase/GBA (E2R1L) Rabbit mAb #88162(上图)或 β-Actin (D6A8) Rabbit mAb #8457(下图)对永生化的 gba+/+ 和 gba-/- 小鼠神经元的提取物进行蛋白质印迹 (WB) 分析。永生化 gba+/+ 和 gba-/- 小鼠神经元细胞系由美国国立卫生研究院国家人类基因组研究所 Ellen Sidransky 博士惠赠。
GCase 是一种溶酶体酶,负责分解糖脂。当 GBA 发生突变时,这一过程受阻,导致 α-突触核蛋白聚集——帕金森病的标志性特征。鉴于其关键作用,GBA 基因替代疗法正在作为潜在治疗方案进行探索,目前已有临床试验 (NCT04127578) 在开展中。8
线粒体调节
线粒体是高效的 ATP 生产者。它们通过裂变、融合和线粒体自噬不断循环,这些过程确保了健康线粒体的供应。然而,在帕金森病中,路易体会破坏这些过程,导致线粒体功能障碍——这是神经元损伤的主要原因。多个参与线粒体调节的蛋白质受路易体影响,使其成为帕金森病研究中极具价值的生物标记物和潜在药物靶标。
|
|
探索相关的抗体小包装组合: •Mitophagy Antibody Sampler Kit #43110 |
|
#5:Parkin
Parkin 是一种泛素连接酶,协助线粒体循环更新。当被 PINK1 磷酸化后,它有助于通过线粒体自噬清除受损的线粒体。Parkin 基因突变与早发性帕金森病相关,凸显了其在疾病进展中的重要性。因此,识别 Parkin 有助于理解线粒体在帕金森病中的作用机制。9
#6:磷酸化 PINK1 (Ser228)
PINK1 是一种调节健康线粒体的丝氨酸/苏氨酸激酶。当线粒体遭受氧化应激等损伤时,PINK1 发生磷酸化,继而磷酸化 Parkin 并启动线粒体自噬。PINK1 的突变会破坏这一过程,导致线粒体积聚并加剧神经元损伤。由于磷酸化 PINK1 可作为神经元氧化应激的标记物,它成为了解帕金森病病理的重要工具。9
#7 DJ-1
DJ-1 是一种氧化还原敏感蛋白,作为抗氧化剂保护线粒体免受氧化应激损伤。早发性帕金森病已被证实与 DJ-1 基因突变相关。
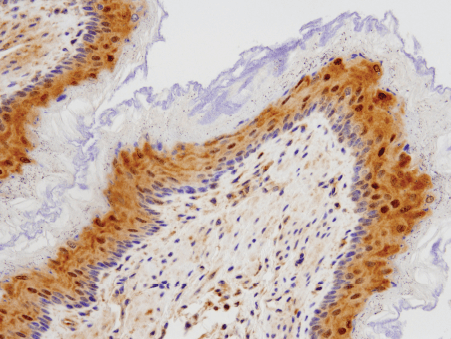
 使用 DJ-1 (D29E5) XP® Rabbit mAb #5933(上图)和 β-Actin (D6A8) Rabbit mAb #8457(下图)对 MEF 野生型、MEF DJ-1 (-/-)、HeLa 和 C6 细胞提取物进行 WB 分析。(MEF 野生型和 MEF DJ-1 (-/-) 细胞由德国图宾根大学的 Philipp Kahle 博士惠赠)。
使用 DJ-1 (D29E5) XP® Rabbit mAb #5933(上图)和 β-Actin (D6A8) Rabbit mAb #8457(下图)对 MEF 野生型、MEF DJ-1 (-/-)、HeLa 和 C6 细胞提取物进行 WB 分析。(MEF 野生型和 MEF DJ-1 (-/-) 细胞由德国图宾根大学的 Philipp Kahle 博士惠赠)。
神经元健康与维持
多种蛋白质参与清除错误折叠蛋白并维持神经元稳态。当这些过程发生故障时,就会引发帕金森病等神经退行性疾病。若干关键蛋白在保护神经元和确保正常废物清除中发挥作用,而作为大脑支持细胞的星形胶质细胞也会影响神经元健康与疾病进展。
#8:UCHL1
泛素羧基末端水解酶 L1 (UCHL1) 是一种去泛素化酶,参与维持泛素池作为其他蛋白质降解的底物。它在神经元中高度表达,保护它们免受错误折叠蛋白质的侵害。然而,其功能因突变和氧化应激而丧失。近期研究已证实该蛋白与帕金森病病理生理学相关。11

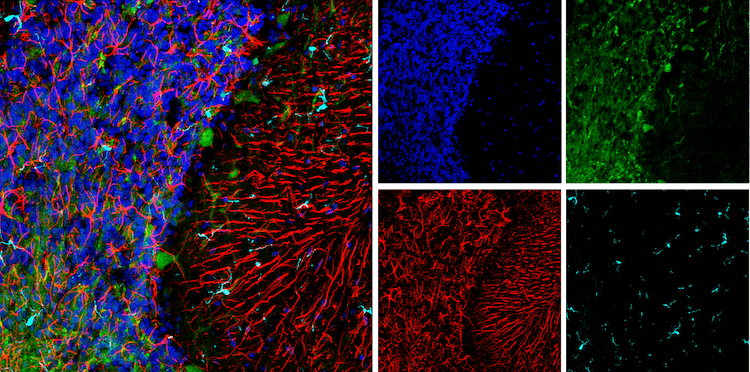
使用 UCHL1 (D3T2E) XP® Rabbit mAb #13179(绿色)和 GFAP (E8S7G) Mouse mAb #95717 (红色)对大鼠小脑组织进行免疫荧光分析。用 Rabbit (DA1E) mAb IgG XP® Isotype Control #3900 封闭游离二抗结合位点后,使用 Iba1/AIF-1 (E4O4W) XP® Rabbit mAb (Alexa Fluor® 647 Conjugate) #78060(伪彩青色)和 ProLong® Gold Antifade Reagent with DAPI #8961(蓝色)对组织进行标记。
#9:LRRK2
富含亮氨酸的重复序列激酶 2 (LRRK2) 对于维持溶酶体功能至关重要,而溶酶体是细胞废物处理的核心。LRRK2 基因突变是家族性帕金森病最常见的遗传诱因之一。这些突变会增强激酶活性,导致溶酶体功能障碍和神经突缺失——两者都是帕金森病进展的关键因素。LRRK2 磷酸化 Rab 家族的几种 GTPase,表明 LRRK2 可能调节细胞内膜转运。鉴于其在神经元健康中的作用,LRKK2 已成为治疗开发的主要靶标。12
 LRRK2 在转染了人 LRRK2 表达载体的 293T 细胞中呈现高表达。图中显示了使用 PathScan® RP Total LRRK2 Sandwich ELISA Kit #69930 检测的空白转染细胞与转染人 LRRK2 表达载体的细胞裂解液蛋白浓度与 450nm 吸光度之间的关系。实验中,293T 细胞分别转染了表达野生型人 LRRK2 的载体或进行空白转染,随后进行细胞裂解处理。
LRRK2 在转染了人 LRRK2 表达载体的 293T 细胞中呈现高表达。图中显示了使用 PathScan® RP Total LRRK2 Sandwich ELISA Kit #69930 检测的空白转染细胞与转染人 LRRK2 表达载体的细胞裂解液蛋白浓度与 450nm 吸光度之间的关系。实验中,293T 细胞分别转染了表达野生型人 LRRK2 的载体或进行空白转染,随后进行细胞裂解处理。
#10:VPS35
液泡分选蛋白 35 (VPS35) 在大脑中大量表达,是逆转录酶复合体的关键组成部分,负责对跨膜蛋白进行分选和回收。它协助 α-突触核蛋白的运输、回收和线粒体的维护。VPS35 基因中的特定 p.D620N 突变与晚发型家族性帕金森病有关。因此,研究其表达和功能有助于找到晚期帕金森病的新治疗靶标。13
帕金森病研究的靶向策略
这套工具箱提供了一套全面而聚焦的帕金森病相关蛋白质研究方案,既能帮助科学家研究帕金森病的病理生理机制,又为诊断和最终治疗提供了潜在生物标记物。
| 靶标 | 产品 | 应用 | 反应性 |
| α-Synuclein | α-Synuclein (E4U2F) XP® Rabbit mAb #51510 | WB、IP、IHC、IF | H, M, R |
| 磷酸化 α-突触核蛋白 | Phospho-α-Synuclein (Ser129) (D1R1R) Rabbit mAb #23706 | WB、IP、IF | H, M, R |
| DDC | DDC (D6N8N) Rabbit mAb #13561 | WB, IP | H, M, R |
| DJ-1 | DJ-1 (D29E5) XP® Rabbit mAb #5933 | WB、IP、IF | H, M, R, Hm, Mk |
| GCase/GBA | GCase/GBA (E2R1L) Rabbit mAb #88162 | WB | H, M, R |
| LRRK2 | LRRK2 (D18E12) Rabbit mAb #13046 |
WB, IP | H, M, R |
| Parkin | Parkin (D4Z1W) Rabbit mAb #32833 | WB | H, M, R |
| PINK1 | PINK1 (D8G3) Rabbit mAb #6946 | WB, IP | H |
| UCHL1 | UCHL1 (D3T2E) XP® Rabbit mAb #13179 | WB, IHC, IF, F | H、M、R、Mk |
| VPS35 | VPS35 (E6S4I) Rabbit mAb #81453 | WB | H、M、R、Mk |
| ELISA 试剂盒与匹配的抗体对 | |||
| α-Synuclein | Total α-Synuclein Matched Antibody Pair #39702 | ELISA | M、R |
| α-Synuclein | PathScan® Total α-Synuclein Sandwich ELISA Kit #54269 | ELISA | M、R |
| LRRK2 | PathScan® RP Total LRRK2 Sandwich ELISA Kit #69930 | ELISA | H, M |
参考文献
- Dawson TM, Ko HS, Dawson VL. Genetic animal models of Parkinson's disease. Neuron. 2010;66(5):646-661. doi:10.1016/j.neuron.2010.04.034
- Sharma B, Shekhar H, Sahu A, et al. Epigenetic insights into prostate cancer: exploring histone modifications and their therapeutic implications. Front Oncol. 2025;15:1570193. Published 2025 Apr 28. doi:10.3389/fonc.2025.1570193
- Parkinson'sFoundation. Who Has Parkinson's? 2025 [cited 2025; Available from: https://www.parkinson.org/understanding-parkinsons/statistics.
- Willis AW, Roberts E, Beck JC, et al. Incidence of Parkinson disease in North America. NPJ Parkinsons Dis. 2022;8(1):170. Published 2022 Dec 15. doi:10.1038/s41531-022-00410-y
- Alfaidi M, Barker RA, Kuan WL. An update on immune-based alpha-synuclein trials in Parkinson's disease. J Neurol. 2024;272(1):21. Published 2024 Dec 12. doi:10.1007/s00415-024-12770-x
- Wang Y, Shi M, Chung KA, et al. Phosphorylated α-synuclein in Parkinson's disease. Sci Transl Med. 2012;4(121):121ra20. doi:10.1126/scitranslmed.3002566
- Shebl, N., Salama, M. Exploring dopa decarboxylase as an ideal biomarker in Parkinson’s disease with focus on regulatory mechanisms, cofactor influences, and metabolic implications. npj Biomed. Innov. 2025;2(2). https://doi.org/10.1038/s44385-024-00005-7
- Blandini F, Cilia R, Cerri S, et al. Glucocerebrosidase mutations and synucleinopathies: Toward a model of precision medicine. Mov Disord. 2019;34(1):9-21. doi:10.1002/mds.27583
- Kondapalli C, Kazlauskaite A, Zhang N, et al. PINK1 is activated by mitochondrial membrane potential depolarization and stimulates Parkin E3 ligase activity by phosphorylating Serine 65. Open Biol. 2012;2(5):120080. doi:10.1098/rsob.120080
- Repici M, Giorgini F. DJ-1 in Parkinson's Disease: Clinical Insights and Therapeutic Perspectives. J Clin Med. 2019;8(9):1377. Published 2019 Sep 3. doi:10.3390/jcm8091377
- Buneeva O, Medvedev A. Ubiquitin Carboxyl-Terminal Hydrolase L1 and Its Role in Parkinson's Disease. Int J Mol Sci. 2024;25(2):1303. Published 2024 Jan 21. doi:10.3390/ijms25021303
- Sosero YL, Gan-Or Z. LRRK2 and Parkinson's disease: from genetics to targeted therapy. Ann Clin Transl Neurol. 2023;10(6):850-864. doi:10.1002/acn3.51776
- Wu A, Lee D, Xiong WC. VPS35 or retromer as a potential target for neurodegenerative disorders: barriers to progress. Expert Opin Ther Targets. 2024;28(8):701-712. doi:10.1080/14728222.2024.2392700





 沪公网安备31011502018823号
沪公网安备31011502018823号