我们很荣幸与 Michael J. Fox 帕金森病研究基金会 (MJFF) 合作,推进帕金森病 (PD) 研究。详细了解有关合作伙伴关系的信息,并探索 PD 资源。
—
我们的细胞采用高度复杂的质量控制系统,以确保细胞健康历经内部和外部应激持续存在。这包括多个复杂且高度受调控的通路,以清除碎片、消除错误折叠的蛋白质并管理有毒细胞组分。可以依据对这些复杂质量控制通路内部各种机制的破坏广泛地确定及界定许多常见的神经系统疾病,包括帕金森病 (PD),这些通路可能随着我们衰老而出问题。
具体而言,PD 特征为多巴胺能神经元中功能丧失,从而导致负责协调移动的神经递质多巴胺减少。在散发性和遗传性 PD 中,这种功能丧失被认为部分是由参与自噬和溶酶体加工的各种蛋白质的破坏引起的,这导致错误折叠蛋白质的积累,并最终导致多巴胺神经元死亡。这种神经元丧失造成 PD 患者中见到的特征性震颤。
相互作用通路:自噬信号转导
近年来,一些维持细胞健康和稳态的关键过程(如自噬、线粒体吞噬和内溶酶体运输)的功能障碍和退化已成为日益关注的治疗性干预焦点。更好地了解促成 PD (其遗传形式和散发形式)的机制正帮助铺平通向新治疗药的道路。
本博客概述了自噬、线粒体自噬和内溶酶体系统在维持神经元稳态中的作用。它还研究了这些通路的中断如何导致帕金森病。此外,博客还总结了目前研究帕金森病溶酶体功能障碍的技术,并引用了最近科学文献中的关键实例。
处于神经元稳态的自噬、线粒体自噬和内溶酶体系统
要了解 PD 的潜在机制和进展,认识健康神经元中自噬、线粒体吞噬和内溶酶体通路的作用必不可少。作为有丝分裂后的分泌型细胞,尤为重要的是维持神经元稳态,一个因神经元轴突与体细胞之间距离长而变得更关键的过程。
.png?width=780&height=338&name=23-EMG-00600-Lysosomal%20%26%20Mitochondrial%20Dysfuntion%20in%20PD%20Blog_Fig%201%20(1).png) 当功能正常时,内溶酶体通路和自溶酶体通路从细胞中移除错误折叠的蛋白质和受损的细胞器。
当功能正常时,内溶酶体通路和自溶酶体通路从细胞中移除错误折叠的蛋白质和受损的细胞器。
自噬和内溶酶体运输确保高效移除错误折叠的、易聚集性蛋白质和受损的细胞器(例如有功能障碍的线粒体),从而令维持适当的细胞稳态成为可能。
细胞基础知识:自噬
作为细胞主要降解通路之一,自噬是一种进化上保守的分解代谢过程,它通过在双膜自噬体中选择性或非选择性吞噬胞浆物质,消除受损的细胞器和错误折叠的蛋白质。在神经元中,自噬体生物发生完全始于远端轴突和突触中1,旨在帮助补充外周中对新蛋白质和新细胞器的持续需求。
神经元中自噬:维持循环的神经递质与自噬之间均衡是一种依赖活动的控制机制。在正发育的神经元中,自噬为修剪树突棘所必需,而在成熟的神经元中,该过程对细胞溶质和突触前蛋白质分选和周转重要,尤其对突触小泡是这样。
细胞基础知识:线粒体自噬
线粒体吞噬是通过自噬选择性降解受损或过量的线粒体,这对维持健康的线粒体网络重要。在神经元中,线粒体吞噬可在细胞体和远端轴突中均发生。
神经元线粒体吞噬: 在神经元中,应激条件下,PINK1 蛋白和 E3 泛素连接酶 Parkin 导引缺陷性线粒体供泛素化。这导致召集自噬装置和泛素结合性自噬受体,例如 p62/SQSTM1 和视神经磷酸酶。然而,值得注意的是,已经证明 PINK1 或 Parkin 丢失不影响体内基础性线粒体吞噬2,3,这表明存在不依赖 PINK1/Parkin 的其他机制,这些机制协同清除功能失调的线粒体。
细胞基础知识:内溶酶体通路
内溶酶体通路存在于所有细胞类型中,是用于分选、调节和回收细胞内部所携各种膜载货的一系列动态细胞器。在此过程期间, AP2 包被的内吞囊泡将来自内化质膜的载货,载货然后通过再循环性内体(标记物:Rab35、Rab11)送返到质膜或沿降解性通路移动。一旦 AP2 包被物移除,含有被导引供溶酶体降解的分子的内吞囊泡融合于早期内体(标记物:Rab5、EEA1),后者然后成熟为晚期内体(标记物:Rab7)。在神经元内溶酶体通路中,晚期内体融合于突触末端处的自噬体(标记物:ATG8、LC3)。它们利用自身的动力蛋白马达,沿微管逐渐移动、酸化并融合于胞体中的溶酶体,以降解其载货货物。
神经元中的内溶酶体运输:在突触后中,内溶酶体通路参与跨膜受体 AMPAR 和 GABAa 的再循环和/或降解,这取决于突触活性。在此过程期间,溶酶体以活性依赖的方式运输,并且可以在突触激活时召集到树突棘,在那里它们降解 AMPAR 和 GABAa。这个动态过程对实现和维持神经可塑性和神经递质释放不可或缺。
帕金森病靶标:PARK 基因
大多数 PD 病例为是散发,而不到 10% 的病例具有遗传组分。然而,涉及可遗传形式的基因(称为 PARK 基因)对阐明其生物学至关重要。许多 PD 风险基因对维持稳态重要并且在内溶酶体通路中发挥作用,这些基因包括编码 α-突触核蛋白、LRRK2、VPS35、Parkin、PINK1 和 DJ1 的基因。4
CST 提供抗体来研究跨自噬和内溶酶体通路因 PD 风险基因所致的功能性蛋白。
- 作为 PD 风险因子的参与自噬和内溶酶体通路的基因:
- 溶酶体酶组织蛋白酶 B
- 溶酶体酶葡糖脑苷脂酶 (GCase/GBA)
- 液泡 ATP 酶亚基 ATP6V0A1
- 溶酶体 K+ 通道 TMEM175
- 与涉及自噬和内溶酶体通路的家族性 PD 相关的基因:
- Synaptojanin-1
- LRRK2
- 溶酶体 ATP 酶 ATP13A2 (PARK9)
- PINK1
- Parkin
帕金森病中的溶酶体破坏和自噬:α-突触核蛋白示例
α-突触核蛋白 (α-syn) 是脑中最丰富的蛋白质之一,它的表达表明在可塑性中发挥作用。5 在健康神经元中正常发挥作用时,α-syn 是一种据信在神经递质释放中发挥作用的突触前蛋白。该蛋白质在翻译后经广泛修饰,并且作为一种天然非结构化的蛋白质,基于该蛋白质存在于其中的细胞环境认为它采用许多不同的构象。6
据信错误折叠的 α-syn 积累及其聚集成称为 Lewy 体的蛋白质包涵体是帕金森病形成和进展中的一个步骤。在病理性环境下,α-syn 通过可溶性寡聚中间体组装而形成聚集物,这些中间体成熟为 Lewy 体中存在的不溶性淀粉样原纤维。寡聚 α-syn (o-α-syn) 作为一种假定性有毒种类已颇受关注。一旦形成,α-syn 聚集物就可以通过细胞间传播扩散遍及整个中枢神经系统,可能以朊病毒样方式扩散。7,8,9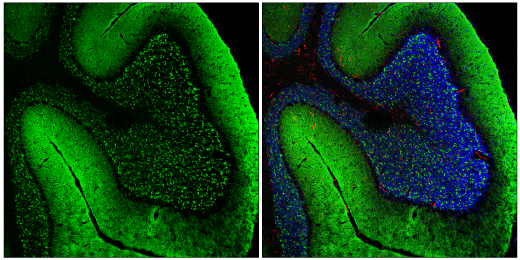
对使用 α-Synuclein (E4U2F) XP® Rabbit mAb #51510(左图,绿色)标记以及使用 F4/80 (BM8.1) Rat mAb #71299(右图,红色)和 DAPI #4083(右图,蓝色)共同标记的固定冷冻的小鼠小脑进行共聚焦免疫荧光分析。
通常,α-syn 被自噬过程清除,但其聚集物可以通过减少 ATG7 并升高 mTOR 水平直接改变自噬-溶酶体通路,从而导致自噬启动不足。虽然聚集的 α-syn 可能在遗传性和散发性 PD 中增强自噬体形成,以满足其降解的更高需求,10 但也证明其过表达抑制自噬体生物发生。11 已证明多巴胺修饰的 α-syn 进一步加剧这个过程,这可能解释 PD 中多巴胺能神经元的选择性脆弱性。12
α-突触核蛋白如何避免帕金森病的退化?
- 在一项研究中,α-syn 突变体 A53T 和 A30P 能够在体外通过伴侣介导的自噬通路阻断自身摄取和溶酶体摄取其他底物供降解。13
- α-syn 聚集物还可以破坏 AV 逆向转运,从而损害自噬体成熟和与溶酶体融合。14,15
在 PD 患者中,α-syn 的修饰形式(例如 o-α-syn 和在 S129 位点磷酸化的 α-syn (pS129α-syn))显著增加,其中 o-α-syn/t-α-syn 比率为区分 PD 和对照的最敏感 (89.3%) 和最特异 (90.6%) 的测试之一。16,17,18,19,20
Michael J. Fox 基金会已组建一个联盟,该联盟正致力于开发一种对聚集形式的 α-syn 有高亲和力和特异性的 PET 示踪剂。仍待确定 α-syn 是否能够按类似于淀粉样蛋白 PET 成像的方式可视化。
研究溶酶体功能障碍的方法
由于它们在自噬和线粒体自噬中的重要作用,了解 PD 患者溶酶体的形态、胞吐作用、酸化、定位、运动和功能对进一步阐明疾病机制重要。存在使用抗体技术研究溶酶体生物学的多种方式,每种方式自身各有利弊。
在这里,我们总结了这些方法中几种,并推荐了一篇科学论文,您或许发现该论文可用于进一步理解这些方法。
-
活性细胞 LysoTracker:该方法提供了活细胞中溶酶体数目及其大小与分布的有用读出,并且尤其用于筛选治疗性化合物。然而,这种方法不能测量溶酶体 pH 值。由探针显示的荧光在很大程度上与 pH 无关,并且在胞内酸性细胞器中无差别地积累。LysoTracker 探针标记溶酶体和晚期内体,因此出于这个原因,荧光信号不应用作溶酶体 pH 值的指标。
-
溶酶体扩张实验步骤:甲基修饰的氨基酸类似物 (LEU-ME) 可以定位于溶酶体,引起触发溶酶体区室快速扩张的腔内渗透效应。固定后,该技术保留了溶酶体形态并且可用于准确定量和分析溶酶体尺寸。但是,本实验步骤仅适用于短期实验。
-
固定的细胞 LAMP 染色实验步骤:任何配备激光显微镜的实验室都可使用,通过荧光显微镜观察溶酶体是一种通过研究溶酶体分布和大小推断溶酶体内部潜在病理性改变的快速可靠方式。由于晚期内体和溶酶体中均存在 LAMP1,因此可能需要第二抗体标记物特异性鉴定溶酶体。
-
使用 HA 标记的 TMEM192 的 Lyso-IP 方法: 这种溶酶体纯化方法非常快(10 分钟即可分离纯且完整的溶酶体),并使用与液相色谱和质谱 (LC/MS) 兼容的缓冲液。然而,溶酶体的整体回收率低,该方法仅适用于稳定表达 HA-TMEM192 的细胞。
-
邻近连接测定法(PLA 技术): 该技术可用于表征参与自噬体起始、延伸和成熟的 40 多种 ATG 蛋白。该技术对任何两种非常接近的蛋白质非常通用,并且可以按定量方式回答许多问题。它还可以用于研究含石蜡的组织样品中或体内生物组织中的蛋白质相互作用。但是,结果高于依赖于探针中所用抗体的质量,并且因批次专有抗体性能,结果可能变异。也可能因非特异性连接寡核苷酸导致背景信号。使用高灵敏度和高特异性抗体,可以最大限度减少这些变量。
除了上述方法和论文外,该资源还分享了分析溶酶体形态、定位、运动和功能的方法,并充分回顾了用于研究溶酶体的当前方法。
用于研究帕金森病的 CST 抗体试剂盒
CST 提供用于表征 PD 中线粒体自噬和内溶酶体通路的精选抗体小包装组合。使用我们的抗体验证标志——六个可以确定抗体在任何给定测定法中功能、特异性和灵敏度的互补策略,验证所有 CST 抗体。
查看以下试剂盒,了解 CST 可以如何帮助推进您的 PD 研究:
- Mitophagy Antibody Sampler Kit #43110
- Autophagy Antibody Sampler Kit #4445
- Parkinson's Research Antibody Sampler Kit #8648
参考文献
- Maday S, Holzbaur EL. Autophagosome biogenesis in primary neurons follows an ordered and spatially regulated pathway. Dev Cell. 2014;30(1):71-85. doi:10.1016/j.devcel.2014.06.001
- Lee JJ, Wedow R, Okbay A, et al. Gene discovery and polygenic prediction from a genome-wide association study of educational attainment in 1.1 million individuals. Nat Genet. 2018;50(8):1112-1121. Published 2018 Jul 23. doi:10.1038/s41588-018-0147-3
- McWilliams TG, Prescott AR, Montava-Garriga L, et al. Basal Mitophagy Occurs Independently of PINK1 in Mouse Tissues of High Metabolic Demand. Cell Metab. 2018;27(2):439-449.e5. doi:10.1016/j.cmet.2017.12.008
- Panicker N, Ge P, Dawson VL, Dawson TM. The cell biology of Parkinson's disease. J Cell Biol. 2021;220(4):e202012095. doi:10.1083/jcb.202012095
- Sulzer D, Edwards RH. The physiological role of α-synuclein and its relationship to Parkinson's Disease. J Neurochem. 2019;150(5):475-486. doi:10.1111/jnc.14810
- Fayyad M, Salim S, Majbour N, et al. Parkinson's disease biomarkers based on α-synuclein. J Neurochem. 2019;150(5):626-636. doi:10.1111/jnc.14809
- Kordower JH, Chu Y, Hauser RA, Freeman TB, Olanow CW. Lewy body-like pathology in long-term embryonic nigral transplants in Parkinson's disease. Nat Med. 2008;14(5):504-506. doi:10.1038/nm1747
- Masuda-Suzukake M, Nonaka T, Hosokawa M, et al. Prion-like spreading of pathological α-synuclein in brain. Brain. 2013;136(Pt 4):1128-1138. doi:10.1093/brain/awt037
- Recasens A, Dehay B, Bové J, et al. Lewy body extracts from Parkinson disease brains trigger α-synuclein pathology and neurodegeneration in mice and monkeys. Ann Neurol. 2014;75(3):351-362. doi:10.1002/ana.24066
- Wong YC, Holzbaur EL. Temporal dynamics of PARK2/parkin and OPTN/optineurin recruitment during the mitophagy of damaged mitochondria. Autophagy. 2015;11(2):422-424. doi:10.1080/15548627.2015.1009792
- Winslow AR, Chen CW, Corrochano S, et al. α-Synuclein impairs macroautophagy: implications for Parkinson's disease. J Cell Biol. 2010;190(6):1023-1037. doi:10.1083/jcb.201003122
- Martinez-Vicente M, Talloczy Z, Kaushik S, et al. Dopamine-modified alpha-synuclein blocks chaperone-mediated autophagy. J Clin Invest. 2008;118(2):777-788. doi:10.1172/JCI32806
- Cuervo AM, Stefanis L, Fredenburg R, Lansbury PT, Sulzer D. Impaired degradation of mutant alpha-synuclein by chaperone-mediated autophagy. Science. 2004;305(5688):1292-1295. doi:10.1126/science.1101738
- Tanik SA, Schultheiss CE, Volpicelli-Daley LA, Brunden KR, Lee VM. Lewy body-like α-synuclein aggregates resist degradation and impair macroautophagy. J Biol Chem. 2013;288(21):15194-15210. doi:10.1074/jbc.M113.457408
- Volpicelli-Daley LA, Luk KC, Lee VM. Addition of exogenous α-synuclein preformed fibrils to primary neuronal cultures to seed recruitment of endogenous α-synuclein to Lewy body and Lewy neurite-like aggregates. Nat Protoc. 2014;9(9):2135-2146. doi:10.1038/nprot.2014.143
- Parnetti L, Chiasserini D, Persichetti E, et al. Cerebrospinal fluid lysosomal enzymes and alpha-synuclein in Parkinson's disease. Mov Disord. 2014;29(8):1019-1027. doi:10.1002/mds.25772
- Parnetti L, Farotti L, Eusebi P, et al. Differential role of CSF alpha-synuclein species, tau, and Aβ42 in Parkinson's Disease. Front Aging Neurosci. 2014;6:53. Published 2014 Mar 31. doi:10.3389/fnagi.2014.00053
- Tokuda T, Salem SA, Allsop D, et al. Decreased alpha-synuclein in cerebrospinal fluid of aged individuals and subjects with Parkinson's disease. Biochem Biophys Res Commun. 2006;349(1):162-166. doi:10.1016/j.bbrc.2006.08.024
- Hansson O, Hall S, Ohrfelt A, et al. Levels of cerebrospinal fluid α-synuclein oligomers are increased in Parkinson's disease with dementia and dementia with Lewy bodies compared to Alzheimer's disease. Alzheimer's Res Ther. 2014;6(3):25. Published 2014 May 7. doi:10.1186/alzrt255
- Aasly JO, Johansen KK, Brønstad G, et al. Elevated levels of cerebrospinal fluid α-synuclein oligomers in healthy asymptomatic LRRK2 mutation carriers. Front Aging Neurosci. 2014;6:248. Published 2014 Sep 25. doi:10.3389/fnagi.2014.00248






 沪公网安备31011502018823号
沪公网安备31011502018823号