病毒感染期间 ER 应激和自噬调节是病毒与宿主存活平衡的重要因素。在本系列中,我们研究了通过细胞对病毒的应答以及对病毒编码蛋白的应答来调节的通路。冠状病毒 SARS-CoV 和 SARS-CoV-2 感染引起严重的肺损伤、肺泡和支气管上皮细胞的广泛受损,并产生肺外损害。
要详细了解不同类型的细胞死亡在病毒感染中的作用,特别是 SARS-CoV-2,请查看这篇文章。
冠状病毒的复制在很大程度上依赖于内质网(ER),这是跨膜病毒蛋白加工所必需的。这样,病毒感染可引起 ER 应激并诱导未折叠的蛋白应答(UPR)。UPR 主要受以下三种通路的活动活性控制:PERK、IRE1a 和 ATF-6。这些途径的激活由 ER 伴侣蛋白 BiP 调节,该伴侣蛋白与辅助修复错误折叠的蛋白结合。BIP 和错误折叠蛋白的累积导致 Perk 和 ATF-6 的解离和激活。PERK 活性可以通过 Thr980 位点的磷酸化进行监测,导致 eIF2a 在 Ser51 位点的磷酸化,从而抑制大多数 mRNA 的翻译,但能够诱导关键转录因子 ATF-4。冠状动脉病毒可诱导转录因子 ATF-6 的激活。在 ER 应激期间,ATF-6 也从 BiP 上解离,然后转移到高尔基体,在高尔基体中它被蛋白酶激活。通过 BiP 的错误折叠蛋白的累积可以直接激活 IRE1a。这导致 XBP1 mRNA 的选择性剪接,将 XBP1 从非剪接形式转换为剪接形式 XPB-1s,XPB-1s 是应激反应基因的有效转录激活因子。这些途径导致其他应激调控基因(如 CHOP 和 GADD34) 的转录,它们共同触发了调节细胞反应的程序,包括细胞死亡和自噬。
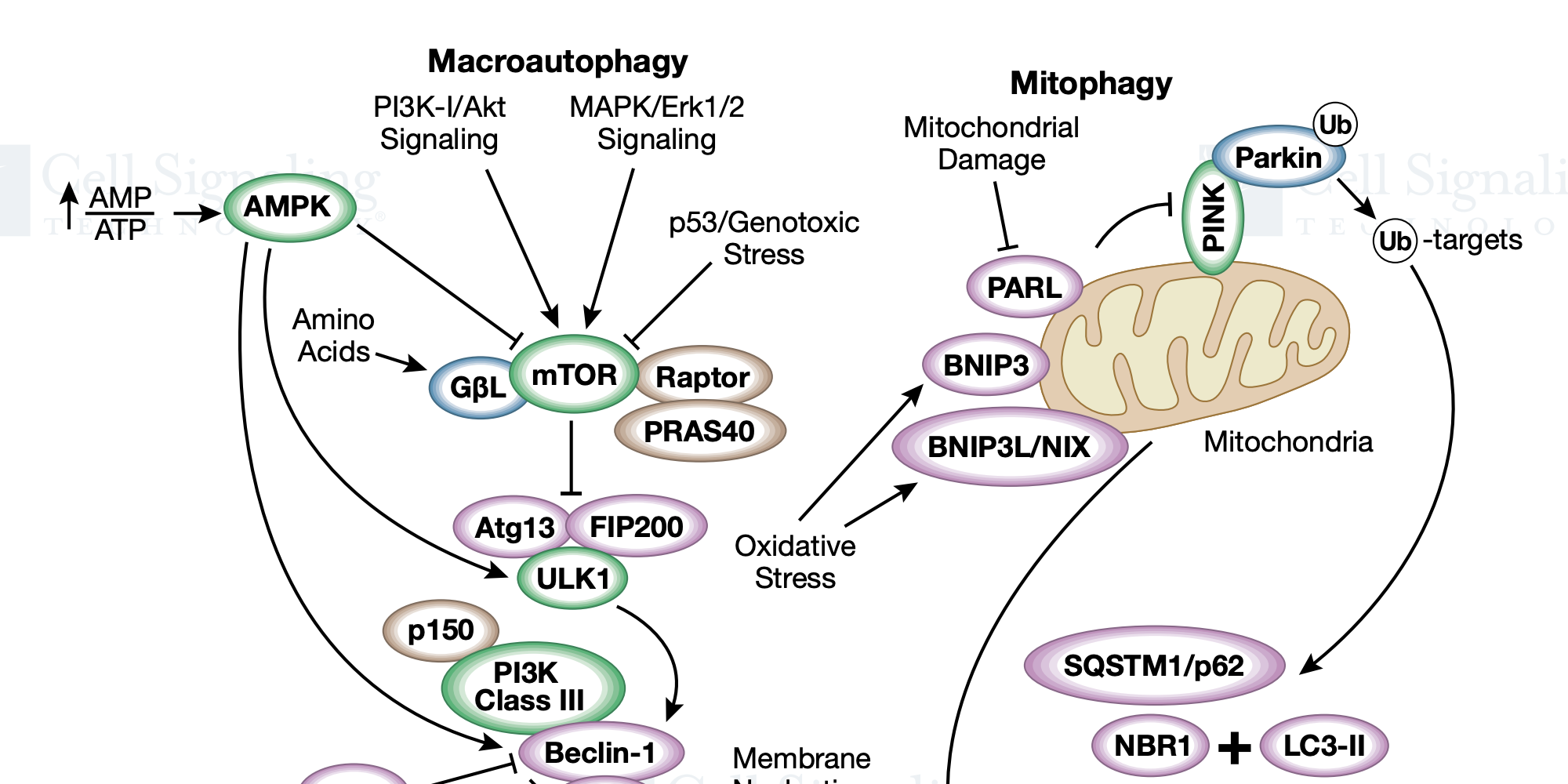
自噬是一种分解代谢过程,用于降解细胞组分,包括蛋白质聚集体、受损的细胞器以及细菌和病毒病原体。该过程涉及将这些组分吞噬入双层膜结构,即自噬小体,其与溶酶体融合以降解。自噬已成为控制病毒感染和免疫的关键过程。自噬在冠状病毒感染中的确切作用尚不清楚,但自噬似乎可能同时发挥促病毒和抗病毒作用。抗疟药氯喹和羟氯喹通过干扰自噬体-溶酶体融合来抑制自噬通量。此外,这些药物还可以阻止内体酸化,从而防止 SARS-CoV 细胞进入。据报道,RNA 病毒会破坏自噬以促进其自身的复制和释放,但是在许多情况下,通过上述的 UPR 过程会刺激自噬。自噬过程通常通过 LC3 染色的自噬体的累积来监控。自噬与 LC3-I 向 LC3-II 的转化有关,在 LC3-II 中,LC3 被脂质化并掺入自噬体膜中,作为降解的各种目标复合物的受体。自噬可以通过能量感应酶 AMPK 和 mTORC1 的拮抗活性来控制。这些激酶对自噬激酶 ULK1 具有相反的作用,该自噬激酶被 AMPK 激活并被 mTORC1 抑制。AMPK 在 Ser555 和 Ser317 位点将 ULK1 磷酸化,而 mTORC1 在 Ser757 位点上将 ULK1 磷酸化。ULK1 磷酸化许多[包括Atg13(Ser355)、Atg14(Ser29)、Beclin-1(Ser15)、Beclin-1(Ser30)] 可促进自噬体形成和成熟的自噬蛋白。mTORC1 还通过在 Ser211 和 Ser122 位点的磷酸化来抑制转录因子 TFEB,并参与溶酶体生物发生的调节。SARS 3a 诱导的溶酶体损伤可激活 TFEB。一些研究表明,抑制 mTORC1 可以促进自噬,对呼吸道冠状病毒具有抗病毒活性。
对感染的反应包括激活 ER 应激和自噬通路,这些通路在病毒的毒性和对宿主组织的损害中起关键作用。这些通路的串扰程度很高,但是出现了新的摄政者来逗弄这些途径,应该会更好地理解。调节这些反应的新兴疗法的作用是引起人们极大关注的领域。
参考文献:
- Fung TS, Liu DX. Coronavirus infection, ER stress, apoptosis and innate immunity. Front Microbiol. 2014 Jun 17;5:296. doi: 10.3389/fmicb.2014.00296. PMID: 24987391; PMCID: PMC4060729.
- Tan YX, Tan TH, Lee MJ, Tham PY, Gunalan V, Druce J, Birch C, Catton M, Fu NY, Yu VC, Tan YJ. Induction of apoptosis by the severe acute respiratory syndrome coronavirus 7a protein is dependent on its interaction with the Bcl-XL protein. J Virol. 2007 Jun;81(12):6346-55. doi: 10.1128/JVI.00090-07. Epub 2007 Apr 11. PMID: 17428862; PMCID: PMC1900074.
- Yue Y, Nabar NR, Shi CS, Kamenyeva O, Xiao X, Hwang IY, Wang M, Kehrl JH. SARS-Coronavirus Open Reading Frame-3a drives multimodal necrotic cell death. Cell Death Dis. 2018 Sep 5;9(9):904. doi: 10.1038/s41419-018-0917-y. PMID: 30185776; PMCID: PMC6125346.
- Siu KL, Yuen KS, Castaño-Rodriguez C, Ye ZW, Yeung ML, Fung SY, Yuan S, Chan CP, Yuen KY, Enjuanes L, Jin DY. Severe acute respiratory syndrome coronavirus ORF3a protein activates the NLRP3 inflammasome by promoting TRAF3-dependent ubiquitination of ASC. FASEB J. 2019 Aug;33(8):8865-8877. doi: 10.1096/fj.201802418R. Epub 2019 Apr 29. PMID: 31034780; PMCID: PMC6662968.
- Meessen-Pinard M, Le Coupanec A, Desforges M, Talbot PJ. Pivotal Role of Receptor-Interacting Protein Kinase 1 and Mixed Lineage Kinase Domain-Like in Neuronal Cell Death Induced by the Human Neuroinvasive Coronavirus OC43. J Virol. 2016 Dec 16;91(1):e01513-16. doi: 10.1128/JVI.01513-16. PMID: 27795420; PMCID: PMC5165216.
- Miller K, McGrath ME, Hu Z, Ariannejad S, Weston S, Frieman M, Jackson WT. Coronavirus interactions with the cellular autophagy machinery. Autophagy. 2020 Sep 23:1-9. doi: 10.1080/15548627.2020.1817280. Epub ahead of print. PMID: 32964796.




 沪公网安备31011502018823号
沪公网安备31011502018823号