球状体和相关的三维 (3D) 细胞模型在研究人员当中迅速流行起来,因为它们能够更准确地再现体内生物学特征,包括组织架构、基因表达和代谢概况,从而超越传统 2D 细胞培养模型的诸多局限。这在癌症研究中尤其如此,其中已经开发癌球状体模型来模拟肿瘤微环境 (TME) 内部的 3D 组织构造。球状体的密集排列瘤样结构及其更准确再现 TME 内部复杂细胞间接触网络的能力,使得对其病理状态代表癌关键特征的生物过程进行情境相关建模成为可能。
当结合传统生化测定法和 2D 细胞测定法使用时,球状体(如图 1 中所示例子)就会成为研究人员工具包中更全面评估生物学过程的另一种工具,并且它们日益被视为评估治疗药功效和安全性的模型。
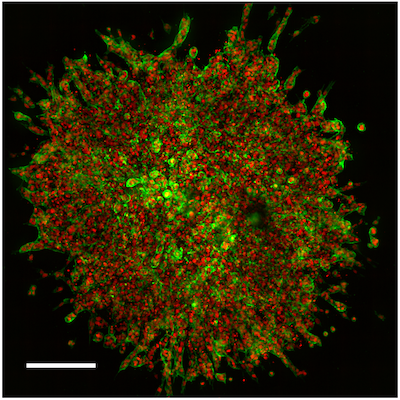 图 1. 使用在 Agilent BioTek Cytation C10 共聚焦成像读取器上成像的 HUVEC 球状体进行 3D 血管生成出芽测定。比例尺对应于 200 μm。
图 1. 使用在 Agilent BioTek Cytation C10 共聚焦成像读取器上成像的 HUVEC 球状体进行 3D 血管生成出芽测定。比例尺对应于 200 μm。
随着高通量药物筛选活动日益利用 3D 细胞模型,必需确保针对3D 模型环境下的使用优化旨在探究球状体内生物功能的试剂。就免疫测定而言,实验步骤和试剂均需经严格测试,以确保抗体有效渗入球状体并与靶标表位特异性结合。诸如样品制备、基质和培养基成分以及球状体大小和密度等因素归属可能潜在影响抗体结合性能——从而影响实验结果的众多因素之列。
最近,CST 的科学家与 Agilent Technologies 合作,展示了 CST ® 抗体如何可以在 Agilent 最先进的成像仪 Agilent BioTek Cytation C10 上用于各种测定类型。为了证明这两种技术一起工作的全面、强有力性质,研究团队按不同生物尺度评估对 TGF-β 信号通路激活的应答:生化模型、2D 细胞模型和 3D 球状体模型。
该项目总结如下,您也可以在应用注释《定量评估血管生成中 TGF-β 信号转导的高通量方法》中找到额外详情。
评估 TGF-β 通路激活的生化、2D 和 3D 检测方法
转化生长因子-β (TGF-β) 信号通路在调节基本细胞过程(包括增殖、分化和迁移)中发挥重要作用,因此在动物发育、健康和疾病中扮演关键角色。TGF-β 信号转导的病理性改变已与许多疾病相关,包括癌症、纤维化疾病和病理性免疫功能障碍。
由于其在各种疾病状态中相关,截至 2023 年,大约有 60 项涉及 TGF-β 信号转导的在研临床试验,还有近 200 项其他临床试验正在积极招募患者。
评估 TGF-β 通路激活:SMAD 磷酸化和移动
典型的 TGF-β 信号转导通路由 30 多种配体组成,这些配体激活属于两个主要信号轴之一的受体。一个通路轴通过 TGF-β 配体-受体相互作用激活,而另一个通路轴通过 BMP 配体-受体相互作用激活。
激活任一通路轴中受体导致受体二聚化和自磷酸化,这引起召集通路特异性受体介导的 SMAD 蛋白 (R-SMAD)并使之磷酸化 ,这些蛋白质是这两个通路轴的主要信号转导分子。因此,使用 SMAD 蛋白磷酸化作为任一轴中配体-受体接合后通路激活的稳健且可靠读出。
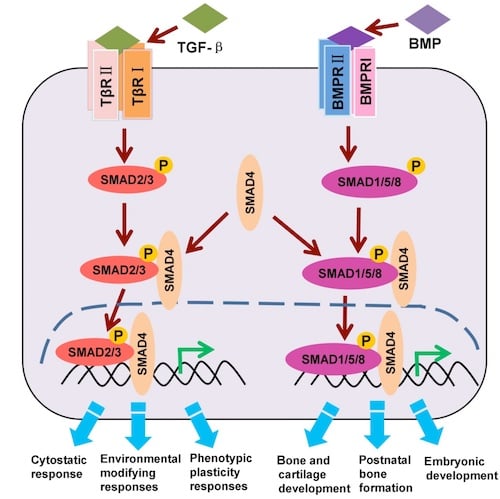 图 2. 典型的 TGF-β/BMP/SMAD信号转导通路(适应性)。
图 2. 典型的 TGF-β/BMP/SMAD信号转导通路(适应性)。
如图 2 所示,SMAD2和/或 SMAD3 的磷酸化表明 TGF-β 通路轴激活,而 SMAD1、SMAD5 和/或 SMAD9(有时称为 SMAD8)的磷酸化表明 BMP 通路轴激活。一旦磷酸化,任一轴上的 SMAD 蛋白召集一种辅助性 SMAD(SMAD4),后者然后移动至胞核并调节靶基因的转录。
评估 TGF-β 通路激活的三种测定法
三个测定法类型(生化模型、2D 细胞模型和 3D 球状体模型)可用于全面评估 TGF-β 信号转导通路和 BMP 信号转导通路的激活。这些测定法测量 SMAD 磷酸化和功能输出的程度,这两者均取决于配体浓度和暴露持续时间并且可用于评估受刺激的血管生成或减少的细胞增殖。
Agilent BioTek Cytation C10 是一款经济实惠的台式共聚焦显影设备,它使自动共聚焦和宽视野显微镜与传统的多模式微量平板读取相结合。独特的设计,包括转盘式共聚焦成像与和宽视野成像组合,实现对诸多样品类型的高分辨率成像能力和光学分层成像能力。
 图 3. Agilent BioTek Cytation C10 共聚焦成像读取器。
图 3. Agilent BioTek Cytation C10 共聚焦成像读取器。
使用来自 CST 的应用特异性抗体和 BioTek Cytation C10 评估 TGF-β/BMP 信号转导,生成以下结果:
生化模型
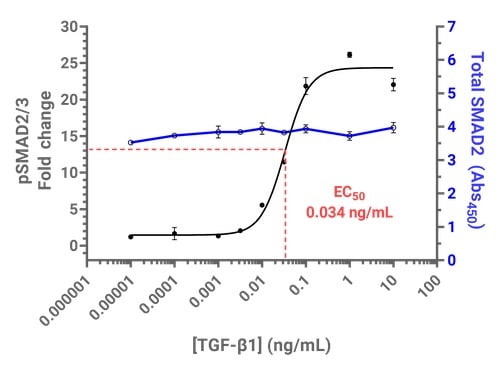 图 4.可在 Cytation C10 上使用 PathScan® ELISA 试剂盒测量 TGF-β1 诱导的 SMAD2/3 磷酸化。上图:使用 PathScan® Phospho-SMAD2 (Ser465/467)/SMAD3 (Ser423/425) Sandwich ELISA Kit 和PathScan® Total SMAD2/3 Sandwich ELISA Kit #12000 时,响应于 TGF-β 的剂量依赖性 SMAD2/3 磷酸化。
图 4.可在 Cytation C10 上使用 PathScan® ELISA 试剂盒测量 TGF-β1 诱导的 SMAD2/3 磷酸化。上图:使用 PathScan® Phospho-SMAD2 (Ser465/467)/SMAD3 (Ser423/425) Sandwich ELISA Kit 和PathScan® Total SMAD2/3 Sandwich ELISA Kit #12000 时,响应于 TGF-β 的剂量依赖性 SMAD2/3 磷酸化。
2D 细胞模型

图 5. 磷酰-特异性 SMAD 抗体和宽视野显影实现高通量定量 2D 细胞培养物中 TGF-β1 诱导的 SMAD2/3 磷酸化和核移动。上图:用载体对照 (A) 或 TGF-β1 (B) 处理的细胞经固定并且使用 Phospho-SMAD2 (Ser465/Ser467) (E8F3R) Rabbit mAb #18338(绿色)做免疫染色。比例尺对应于 100 μm。
3D 球状体模型
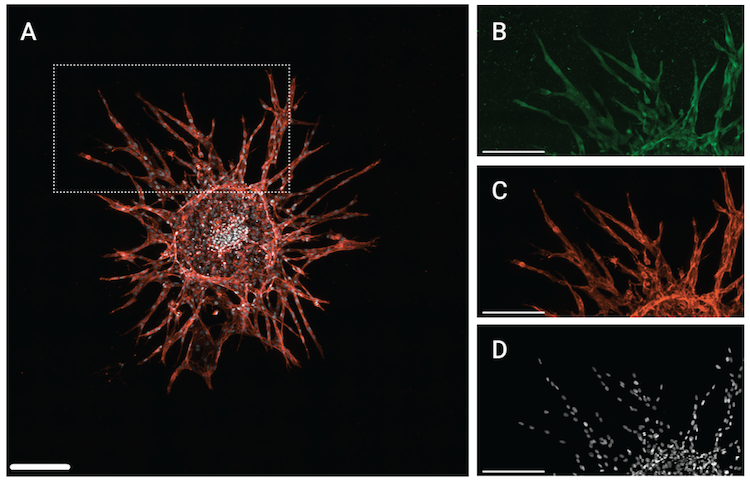
图 6. 使用 3D 出芽血管生成模型测量 SMAD4 表达。上图:(A) 具有血管生成性萌芽的 HUVEC 球状体的 3 x 3 剪辑 Z 堆栈的最大投影。(B) 至 (D) 显示 (A) 中的小图区域,连同 (B) 使用 SMAD4 (D3R4N) XP® Rabbit mAb #46535时 SMAD4 的信号,(C) 使用 CD31 (PECAM-1) (D8V9E) XP® Rabbit mAb #77699 时 PECAM-1的信号,以及 (D) 使用 DRAQ7 #7406时DRAQ7 的信号。比例尺对应于 200 μm。
如上图所示,使 SMAD4 抗体用来在球状体模型中评估通路激活,而磷酰-SMAD 抗体用于生化模型和 2D 细胞模型中。这是因为与磷酰-SMAD 抗体相比,SMAD4 抗体在 3D 模型中生成最佳的信噪比,这表明并非所有试剂在所有场景下同等表现。由于 SMAD4 在 TGF-β 通路和 BMP 通路二者中作为辅助性 SMAD 召集,因此它充当了 SMAD 复合体定位/移动的有用标记物。
用于 3D 模型中免疫染色的抗体
体外模型系统是理解生物学过程所需的基础工具,但它们在可以复现体内生物学的程度方面有局限性。合并更好反映体内组织架构的 3D 球状体模型,可以为辨识潜在的治疗靶标及评估药物安全性提供更准确的筛选环境。
利用高质量、应用专属抗体以及最先进的成像技术,可以提供为定量评估生物学过程和推动新治疗药开发所需的工具。
其他资源
- SLAS2023 视频演示: 一种定量评估 SMAD 信号转导通路的多尺度方法
- 演讲嘉宾:Antony Wood 博士(CST 产品设计与战略高级总监)和 Ernest Heimsath 博士(Agilent Technologies 应用开发科学家)
- 交互式通路图:
Antony (Tony) Wood 博士是 CST 产品设计与战略高级总监,为本文的撰写做出了贡献。23-BPA-25500







 沪公网安备31011502018823号
沪公网安备31011502018823号