上皮-间质细胞转换 (EMT) 是一种生物学过程,上皮细胞通过该过程获得迁移能力,从而能够脱离其原始组织。1 在正常情况下,EMT 对伤口愈合和组织再生起着关键作用。然而,当癌细胞劫持这一机制时,它便具有病理学意义,并可能促进肿瘤扩散。
EMT 与肿瘤发展的早期和晚期阶段均有关联。随着肿瘤开始转移,这一过程帮助癌细胞适应新环境,提高其生存几率,并促使全身形成侵袭性肿瘤。值得注意的是,EMT 可能在肿瘤达到临床可检测水平之前就已发生,这使得早期诊断和预防变得尤为困难。
更复杂的是,经历 EMT 的癌细胞通常对化疗、放疗和靶向治疗等疗法表现出更强的耐药性,并且在初始治疗后更容易复发。
 |
探索相关的 CST 抗体小包装组合,其中包含本博客提到的多种标记物检测试剂: • Epithelial-Mesenchymal Transition (EMT) Antibody Sampler Kit #9782 |
|
为了更好地理解和应对这些挑战,研究人员正聚焦于一系列 EMT 标记物。这些标记物可能为改善早期检测、抑制转移和增强治疗反应提供关键线索。在本篇博客中,我们将深入探讨一些最具潜力的 EMT 标记物,以及它们可能揭示的癌症进展与治疗耐药机制。
<Jump to the product list at the end of this post>
EMT 标记物在癌症研究中的应用
越来越多的研究表明,EMT 并非简单的“全有或全无”过程——相反,癌细胞往往处于一系列中间状态,同时表现出上皮和间质特征。这种细胞可塑性使肿瘤细胞能够适应不同环境、逃避免疫系统,并在包括癌症治疗在内的各种压力下存活。正是由于这种动态特性,识别和追踪 EMT 标记物已成为癌症研究的有力工具,可帮助揭示肿瘤进展、转移和治疗耐药性的机制。
1. 细胞黏附蛋白的变化
EMT 的显著特征之一是两种跨膜蛋白水平的改变:E-钙黏蛋白和 N-钙黏蛋白。
|
使用重组单克隆抗体 E-Cadherin (24E10) Rabbit mAb #3195 对石蜡包埋的人前列腺腺癌组织进行 |
|
在 EMT 过程中,负责维持紧密细胞黏附的 E-钙黏蛋白表达下调,而 N-钙黏蛋白表达上调。这种“钙黏蛋白转换”使癌细胞能够脱离原发肿瘤并迁移至身体其他部位。2 这两种蛋白被视为 EMT 的核心标记物。
其他黏附相关蛋白也会受到影响。 ZO-1 是一种连接跨膜连接蛋白与肌动蛋白细胞骨架的周边膜适配蛋白,通常在 EMT 过程中减少,从而增强细胞运动性和转移潜能。
同样,对紧密连接完整性至关重要的跨膜蛋白 occludin 水平下降,也可能预示着黏附减弱和 EMT 进展。
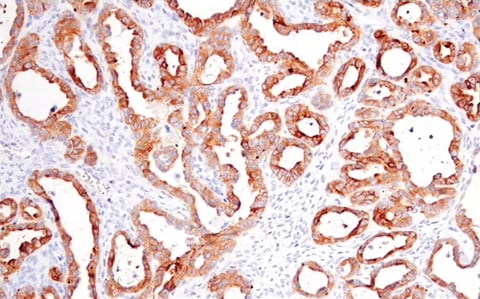
使用重组单克隆抗体 Occludin (E6B4R) Rabbit mAb #91131 对石蜡包埋的人卵巢透明细胞癌组织进行免疫组织化学分析。
EpCAM 是另一种在许多癌细胞中高表达的跨膜蛋白。虽然它在传统意义上不属于 EMT 标记物,但其表达升高也有助于肿瘤组织鉴定。
2. 细胞骨架蛋白的紊乱
细胞骨架变化是 EMT 的另一个指标。例如,肌成纤维细胞通常表达细胞骨架蛋白α-平滑肌肌动蛋白 (SMA),以支持伤口修复。3 但在 EMT 过程中,癌细胞和癌症相关成纤维细胞 (CAF) 也会产生大量 SMA,其水平升高通常与不良预后相关。
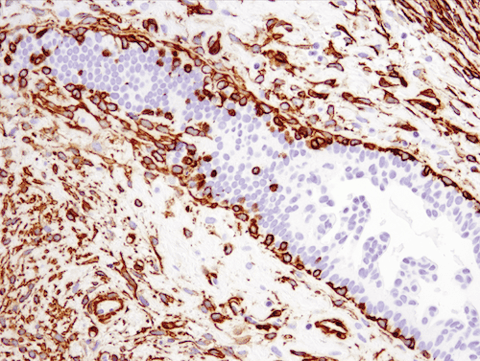
使用重组单克隆抗体 α-Smooth Muscle Actin (D4K9N) XP® Rabbit mAb #19245 对石蜡包埋的人乳腺导管癌组织进行免疫组织化学分析。
波形蛋白(Vimentin,一种中间丝蛋白)是另一种重要的标记物。它的上调标志着间质状态,可增强运动性和侵袭能力。
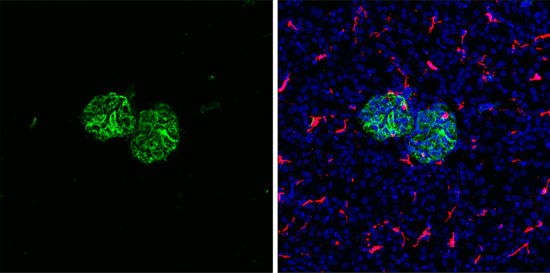
对用重组单克隆抗体 Vimentin (D21H3) XP® Rabbit mAb #5741(左图,绿色)标记并用 F4/80 (BM8.1) Rat mAb(右图,红色)和 ProLong® Gold Antifade Reagent with DAPI #8961(右图,蓝色)共标记的固定冰冻小鼠肾脏组织进行免疫荧光 (IF) 分析。
纤维连接蛋白 (fibronectin) 作为细胞外基质 (ECM) 的主要蛋白,在 EMT 过程中也显著上调。作为间质状态的标记物,纤连蛋白不仅是 EMT 的指标,更能通过促进细胞黏附、迁移及与肿瘤微环境 (TME) 的相互作用,积极促进肿瘤的发展、侵袭和转移。
3. 调控 EMT 的转录因子
有多种转录因子可通过抑制上皮特性来推动 EMT 进程。4
首先,E-钙黏蛋白表达的抑制由 SNAIL、SLUG 和 ZEB1 等因子驱动。这些转录抑制因子在 EMT 过程中通常上调,对启动该过程起关键作用。
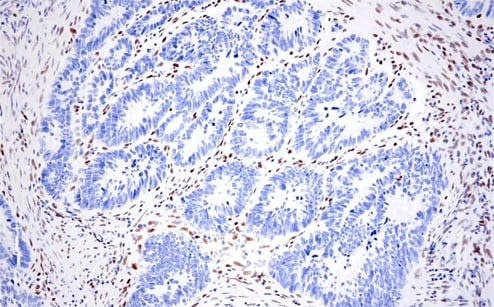
使用重组单克隆抗体 ZEB1 (E2G6Y) XP® Rabbit mAb #70512 对石蜡包埋的人结肠腺癌组织进行免疫组织化学分析。
TWIST 作为一种碱性螺旋-环-螺旋 (BHLH) 转录因子,也能通过抑制 E-钙黏蛋白表达和促进间质表型发挥作用。4
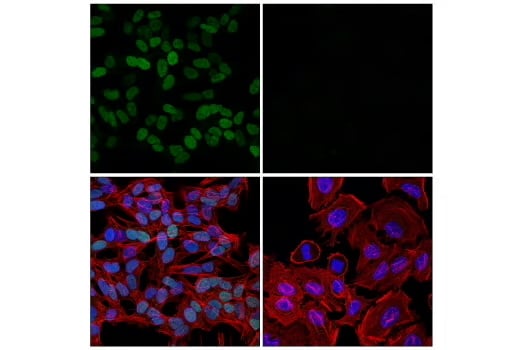
使用重组单克隆抗体 TWIST1 (E5G9Y) Rabbit mAb #90445(绿色)、DyLight™ 650 Phalloidin #12956(红色)和 DAPI #4083(蓝色)对 SH-SY5Y 细胞(左图,阳性)和 HeLa 细胞(右图,阴性)进行免疫荧光分析。
Oct-4 和 Nanog 等因子还通过诱导干细胞样特性来促进 EMT,使细胞能够快速自我更新并更有效地转移。
4. 触发 EMT 的信号转导蛋白
EMT 还可由多种信号转导蛋白的存在所触发。
其中一种蛋白是 DDR2,这是一种受体酪氨酸激酶,通过与细胞外基质胶原结合被激活,从而导致包括多种 EMT 标记物上调在内的基因调控变化。当 DDR2 被沉默时,EMT 标记物的数量会减少。5
β-连环蛋白同样发挥着重要作用,尤其是在刺激 EMT 发生的 Wnt 信号转导通路中。6

使用重组单克隆抗体 ß-Catenin (D10A8) XP® Rabbit mAb #8480 对石蜡包埋的人类前列腺腺癌组织进行免疫组织化学分析。
另一个贡献者是 CD31/PECAM1,这是一种通常与免疫应答相关的细胞黏附分子。它深度参与血管生成过程,既能促进肿瘤血管化,又能推动 EMT 进展。 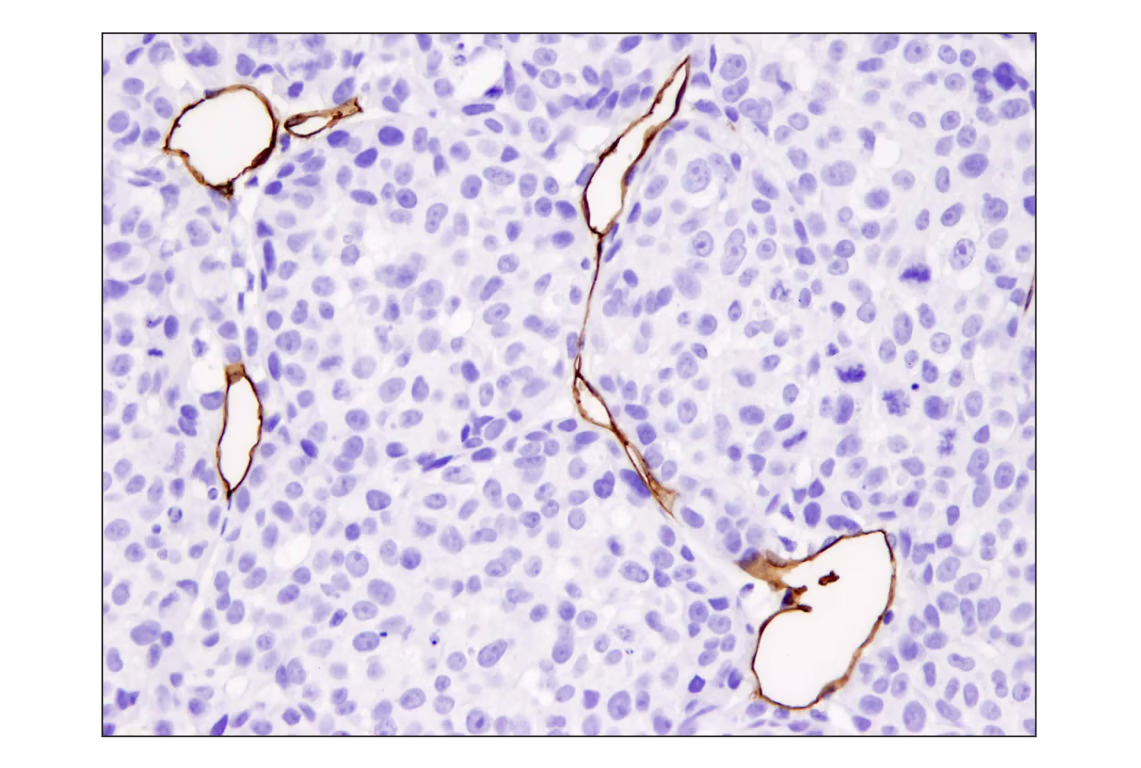
使用重组单克隆抗体 CD31 (PECAM-1) (D8V9E) XP® Rabbit mAb 对石蜡包埋的 A2058 异种移植物进行免疫组织化学分析。
癌症研究的潜力靶标
约 90% 的癌症相关死亡由转移导致。5 要改善癌症患者的预后,关键在于更清晰地理解转移发生的机制和原因。
本文讨论的每种标记物都有助于识别 EMT(转移的重要驱动因素)可能发生的部位。通过研究这些标记物的行为及其相互作用,研究人员致力于开发更早检测和更有效治疗的工具。
虽然要完全理解其深层机制仍需大量研究,但每一项发现都让我们更接近早期干预和更好的长期预后——最终将提升患者的生存率和生活质量。
参考文献
- Nisticò P, Bissell MJ, Radisky DC. Epithelial-mesenchymal transition: general principles and pathological relevance with special emphasis on the role of matrix metalloproteinases. 《冷泉港实验室生物学展望》. 2012;4(2):a011908.
- Loh CY, Chai JY, Tang TF, Wong WF, Sethi G, Shanmugam MK, Chong PP, Looi CY. The E-Cadherin and N-Cadherin Switch in Epithelial-to-Mesenchymal Transition: Signaling, Therapeutic Implications, and Challenges. Cells. 2019;8(10):1118.
- Sousa AM, Liu T, Guevara O, Stevens J, Fanburg BL, Gaestel M, Toksoz D, Kayyali US. Smooth muscle alpha-actin expression and myofibroblast differentiation by TGFbeta are dependent upon MK2. J Cell Biochem. 2007;100(6):1581-1592.
- Debnath P, Huirem RS, Dutta P, Palchaudhuri S. Epithelial-mesenchymal transition and its transcription factors. Biosci Rep. 2022;42(1):BSR20211164.
- Kim D, You E, Jeong J, et al. DDR2 controls the epithelial-mesenchymal-transition-related gene expression via c-Myb acetylation upon matrix stiffening. Sci Rep. 2017;7:6847.
- Xue W, Yang L, Chen C, Ashrafizadeh M, Tian Y, Sun R. Wnt/β-catenin-driven EMT regulation in human cancers. Cell Mol Life Sci. 2024;81(1):79.

 使用重组单克隆抗体
使用重组单克隆抗体 




 沪公网安备31011502018823号
沪公网安备31011502018823号