开始使用流式细胞术或开始从单纯处理活细胞扩展到固定和透化实验步骤,可能是一项艰巨但有益的任务。您不仅可以深入了解表面蛋白质表达的差异,还可以洞悉胞内蛋白质表达、磷酸化状态等的差异。综合这些类型的读出可以一起为细胞群体及其信号转导特征提供独特理解。鉴于可用的多种实验步骤,我们开发了流式细胞术抗体染色指南,可供全球研究人员下载,以帮助揭开抗体染色过程的神秘面纱,并逐步指导您完成检测设置。使用抗体染色指南和这篇博文中的决策树步骤,我们旨在解决您可能遇到的一些常见问题。
我如何为流式细胞术实验着染表面蛋白?
我们首先来看一个场景,您有需要通过一对表面蛋白 CD4 和 TCRβ 对小鼠脾细胞进行染色。每个靶标都有经流式验证的小鼠反应性的抗体偶联物:CD4 和 TCRβ。(注:克隆 H57-597 克隆,针对 TCRβ,在本博客中讨论,已停产。)虽然您知道每种蛋白质都位于质膜上,但您需要检查抗体是否识别每种蛋白质的细胞外或细胞内部分。
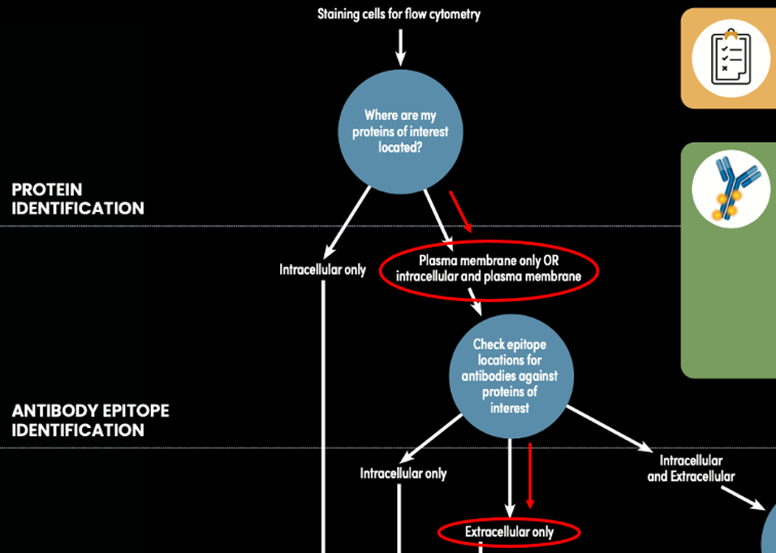 图 1:使用流式细胞术抗体染色指南(用红线和圆圈表示),确定 CD4 (RM4-5) 示例和 TCRβ (H57-597) 示例的适当染色实验步骤路径。
图 1:使用流式细胞术抗体染色指南(用红线和圆圈表示),确定 CD4 (RM4-5) 示例和 TCRβ (H57-597) 示例的适当染色实验步骤路径。
每种 CST 抗体的产品网页都包括其中可以找到抗原基本信息的来源/纯化部分。这个部分可能列出蛋白质的 N 端或 C 端部分或中心氨基酸,或者该页面可能简单地说到,抗体检测在胞外或胞内结构域内部的表位。如果您不确定,请联系技术支持获取更多信息。
参考产品页,靶向 CD4 的 RM4-5 克隆和靶向 TCRβ(已停产)的 H57-597 克隆,均检测其各自靶标的细胞外结构域。这意味着您可以同时使用两种抗体着染活细胞。由于您在同一实验中复用两种抗体,因此您需要选择具有不同激发/发射特征的荧光团以避免或尽量减少补偿的需要。您决定采用 APC 和 FITC。综上所述,用 CD4 (RM4-5) Rat mAb (APC Conjugate) 和 TCRβ (H57-597) Hamster mAb (FITC Conjugate)(产品已停产)染色活性小鼠脾细胞后得到的结果如下:
 图 2:使用活细胞实验步骤,对采用 Armenian Hamster Isotype Control (FITC Conjugate)(右图)或浓度匹配的 Armenian Hamster Isotype Control (FITC Conjugate)(左图)染色的 C57BL/6 脾细胞进行分析。样品用 CD4 (RM4-5) Rat mAb (APC Conjugate) 共染色
图 2:使用活细胞实验步骤,对采用 Armenian Hamster Isotype Control (FITC Conjugate)(右图)或浓度匹配的 Armenian Hamster Isotype Control (FITC Conjugate)(左图)染色的 C57BL/6 脾细胞进行分析。样品用 CD4 (RM4-5) Rat mAb (APC Conjugate) 共染色
如何对同一样本的表面蛋白和细胞内蛋白染色以进行流式细胞术实验?
当然,收集细胞表面蛋白表达数据非常有用,但您可能还想要细胞内部正发生什么的信息。通常,了解表面蛋白表达谱允许您鉴定样品中存在的细胞类型,与此同时,检查胞内蛋白和翻译后修饰可以洞悉细胞正如何运作。在这个场景中,您对 T 细胞的 Tox/Tox2 表达感兴趣(您可以在外周血单个核细胞 (PBMC) 群中依据 CD3 表达鉴定 T 细胞)。由于您正在探测某种胞内蛋白 (Tox/Tox2),因此您知道将需要固定和透化。
与其在实验室里投入额外时间依次着染样品,不如首先通过查阅 CST 实验步骤兼容性表核实 CD3 共染色剂是否可用于固定和透化的细胞。
识别胞外表位的人反应性 CD3 克隆 UCHT1在 CST 通常推荐的所有固定和透化实验步骤中均良好发挥作用。这意味着您将能够在固定和通透后,通过同时用抗 anti-CD3 (UCHT1) 和抗 Tox/Tox2 (E6G5O) 抗体给 PBMC 染色来节省一些时间。为了固定和透化,您可以使用推荐用于 Tox/Tox2 抗体的 4% 甲醛固定和 90% 冰冷甲醇透化实验步骤。所有试剂均单独可提供,或在 Intracellular Flow Cytometry Kit (Methanol) #13593 中可提供。
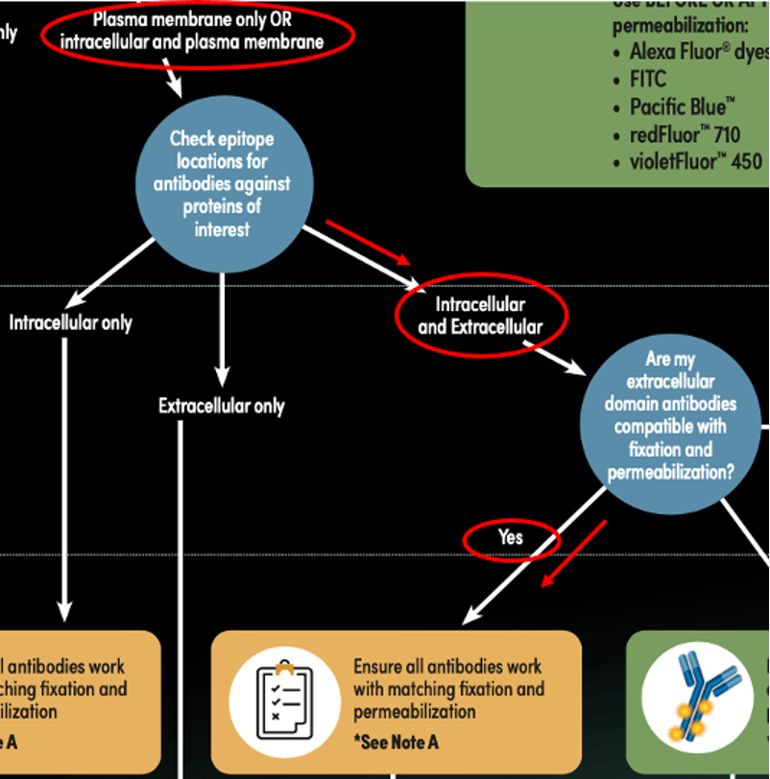 图 3:使用流式细胞术抗体染色指南(以红线和圆圈表示),为 CD3 (UCHT1) 和 Tox/Tox2 (E6G5O) 示例确定适当的染色实验步骤l路径。
图 3:使用流式细胞术抗体染色指南(以红线和圆圈表示),为 CD3 (UCHT1) 和 Tox/Tox2 (E6G5O) 示例确定适当的染色实验步骤l路径。
以下是样本的情况 - 您有不同的 PBMC 群体,它们分别属于四个象限:
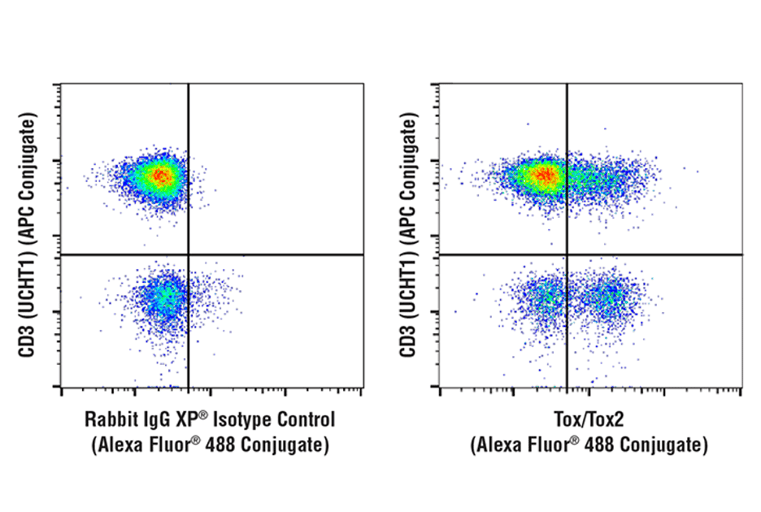 图 4:使用 Tox/Tox2 (E6G5O) Rabbit mAb (Alexa Fluor® 488 Conjugate)(右图)或浓度匹配的 Rabbit (DA1E) mAb IgG XP® Isotype Control (Alexa Fluor® 488 Conjugate), 对淋巴细胞群上设门的固定和透化的人 PBMC 进行分析。样品用 CD3 (UCHT1) Mouse mAb (APC Conjugate) 共染色。
图 4:使用 Tox/Tox2 (E6G5O) Rabbit mAb (Alexa Fluor® 488 Conjugate)(右图)或浓度匹配的 Rabbit (DA1E) mAb IgG XP® Isotype Control (Alexa Fluor® 488 Conjugate), 对淋巴细胞群上设门的固定和透化的人 PBMC 进行分析。样品用 CD3 (UCHT1) Mouse mAb (APC Conjugate) 共染色。
不能同时染着表面蛋白质和胞内蛋白质时怎么办
很遗憾,存在将不能用您的所有抗体对样品同时染色的情况。下一个示例中,您想要确定表达转录因子 BATF3 的 CD11c 阳性 PBMC 的比例。像以前一样,您对胞内靶标和膜靶标感兴趣。
这一次,实验步骤兼容性表向您显示,人反应性 CD11c (3.9) 克隆在活细胞上表现良好,但在已采用除 FoxP3/转录因子实验步骤以外的任何实验步骤固定和透化的细胞上表现不佳。您还有另一个考虑因素:您看中的 BATF3 (E3K5H) 克隆没有可供选择的直接偶联物。(注:本博客发布后,BATF3 (E3K5H) 克隆的 OTS 偶联物已经上市。在此处查看:BATF3 (E3K5H) 克隆)。幸运的是,您只使用了一种共染色剂(CD11c),并且它是在与 BATF3 抗体(兔)不同的动物(小鼠)中培养的,因此您将能够使用抗兔二抗来检测 BATF3。
由于 BATF3 抗体产品页面建议使用甲醛固定,随后进行甲醇透化,因此您计划首先用 CD11c 抗体对活 PBMC 染色,然后遵循对 BATF3 推荐的实验步骤操作。
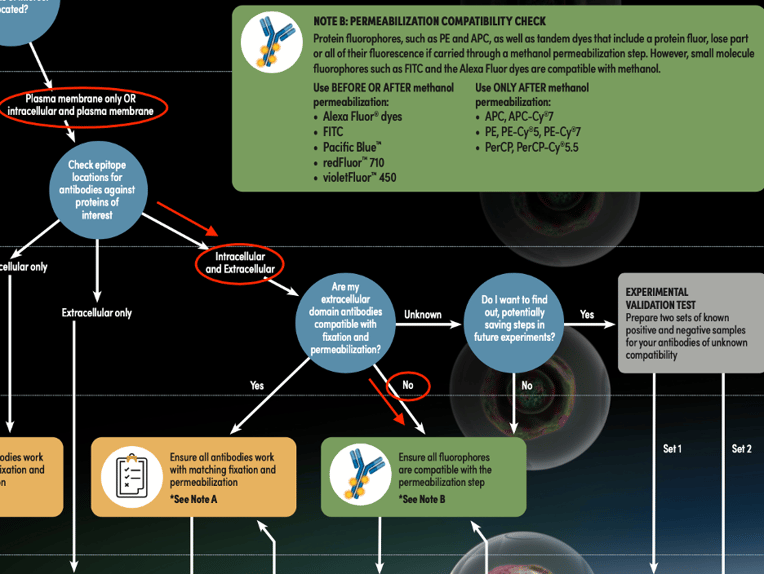 图 5:使用流式细胞术抗体染色指南(以红线和圆圈表示),确定 CD11c (3.9) 和 BATF3 (E3K5H) 示例的适当染色实验步骤路径。
图 5:使用流式细胞术抗体染色指南(以红线和圆圈表示),确定 CD11c (3.9) 和 BATF3 (E3K5H) 示例的适当染色实验步骤路径。
查看决策树中的标注,您发现甲醇是一种有机溶剂,可以使蛋白质荧光团变性,因此您确保选择一种与小分子荧光团偶联的 CD11c 抗体,在这种情况下,FITC 会在通过甲醇通透步骤时保留其荧光。样品用 CD11c FITC 偶联物标记后,固定和通透样品,用 BATF3 抗体进行孵育后,然后用抗兔 Alexa Fluor® 647 偶联二抗染色。一旦您已经运行样本并分析数据,则结果就是对于两种读出明确分离阳性群体和阴性群体:
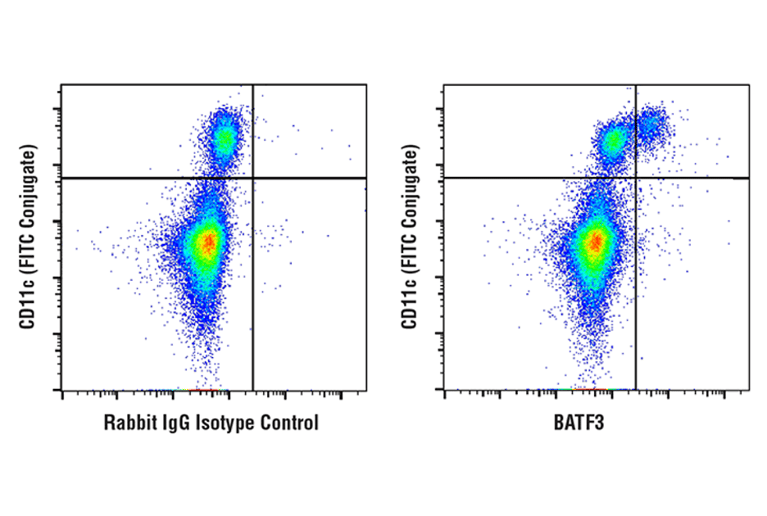 图 6:固定前用 CD11c (3.9) Mouse mAb (FITC Conjugate)共染色,使用 BATF3 (E3K5H) Rabbit mAb(右图)或浓度匹配的 Rabbit (DA1E) mAb IgG XP® Isotype Control(左图),对固定和透化的人外周血单核细胞进行分析。Anti-rabbit IgG (H+L), F(ab')2 Fragment (Alexa Fluor® 647 Conjugate) 用作二抗。
图 6:固定前用 CD11c (3.9) Mouse mAb (FITC Conjugate)共染色,使用 BATF3 (E3K5H) Rabbit mAb(右图)或浓度匹配的 Rabbit (DA1E) mAb IgG XP® Isotype Control(左图),对固定和透化的人外周血单核细胞进行分析。Anti-rabbit IgG (H+L), F(ab')2 Fragment (Alexa Fluor® 647 Conjugate) 用作二抗。
在这里描述的场景中,我们参考了流式细胞术抗体染色指南和实验步骤兼容性表来指导样品被两种抗体染色的情况,但您也可以使用这些资源来指导您在使用三种或更多读数进行多重分析时的决策。无论您染色的是活细胞、固定和通透细胞,还是两者的组合,一定要考虑一般的流式细胞术注意事项,例如包括适当的控制和尽量减少荧光团的光谱重叠。最后,如果您需要额外的荧光团灵活性,请考虑咨询 CST 定制抗体偶联服务。祝您实验成功!






 沪公网安备31011502018823号
沪公网安备31011502018823号