人体中大量的 DNA 确实令人困惑。单个体细胞的 DNA 端对端地延伸,大约 2 米长,将普通人的所有 DNA 都伸展开来,它们可到达太阳系的尽头再绕回来!
我们的 DNA 序列中有 30 亿个碱基对,必须对它们进行读取、解码和翻译,才能对环境和体内的变化做出反应。为了组织这个过程,将 DNA 压缩成染色质:包裹在组蛋白核心八聚体周围的 DNA 形成核小体,然后可以将其进一步压缩成高级染色质纤维。一旦压缩,紧密缠绕的染色质将不再被转录,除非通过各种蛋白复合物和组蛋白修饰使其变成常染色质。这就是 ATP 依赖的染色质重塑剂发挥作用的地方。
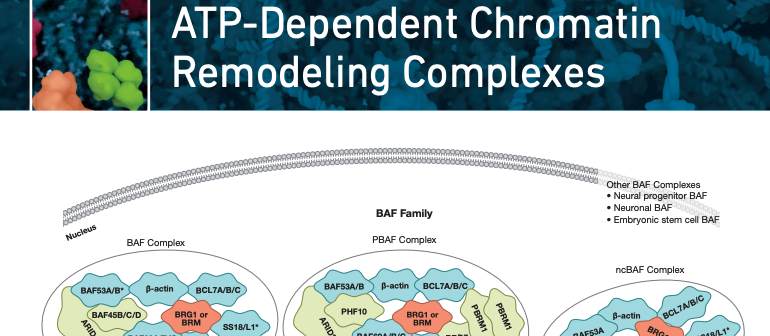
ATP 依赖的重塑剂依靠 ATP 水解来取代核小体,从而允许转录因子的进入。尽管多种蛋白质复合物具有此功能,但最近的研究表明,在一组称为 BAF(Brahma 相关因子)的蛋白质中,癌症中突变的发生率特别高。多年来,研究人员一直在研究 BAF 复合物,但是随着–组学技术和大数据的出现,这些染色质重塑剂在癌症和疾病中的关键作用才刚刚被阐明。实际上,已显示出近四分之一的人类癌症中 BAF 复合物成员具有突变 (1)。
但是,为什么 BAF 中的突变在肿瘤中如此普遍?这个问题的答案与复合物本身一样复杂。我们知道,许多 BAF 蛋白各自起着抑癌因子作用,它们的突变会导致侵略性癌症类型,如横纹肌瘤(无 BAF47 表达)和卵巢透明细胞癌(无 ARID1A 表达)(2, 3)。横纹肌瘤的突变负荷特别低,BAF47 是少数突变的基因之一。
在其他情况下,BAF 复合体成员已被证明是癌症的驱动因素。滑膜肉瘤是一种罕见的肿瘤类型,由 BAF 成员 SS18 的 N 端与 SSX1、2 和 4 蛋白的 C 端的致癌融合驱动。当掺入 BAF 中时,SS18/SSX 癌蛋白可将野生型 BAF47 逐出,并有效地将复合物劫持到基因组的不同部分,从而表达致癌因子,例如 Sox2 (4,5)。BAF 复合物的这种致癌劫持也已在含有 TMPRSS2-ERG 融合的前列腺癌中得到证实 (6)。
要真正了解这些不同的亚基如何促进肿瘤发生,我们必须了解 BAF 复合体的微妙机制。直到最近,人们对 BAF 复合体的形成方式甚至所有成员的身份知之甚少。事实证明,有超过 25 个不同的亚基,其中许多是互斥的同系物,包括 3 个不同的复合物。每个复合物通过将 BAF60 同系物添加到 BAF155/170 同源或异源二聚体而开始形成。从那里开始,可变的亚基被掺入形成经典的 (BAF)、非经典的 (ncBAF) 或包含 BAF180/PBRM1 的 BAF (PBAF) 复合物。每个复合物在基因组中占据不同的空间,表明它们都具有独特的功能。
除了三种主要复合物外,还存在组织和细胞类型特异性的 BAF 复合物。随着神经前体细胞进入有丝分裂后神经元,亚基被交换形成神经特异性 BAF 复合物 (nBAF) (7)。nBAF 在正常的脑功能中起关键作用,各种成员的突变会导致发育异常,例如 Coffin-Siris 综合征 (8-10)。胚胎干细胞还具有称为 esBAF 的 BAF 特定变体,这对于自我更新和多能性至关重要 (11, 12)。
在先前无法治愈的肿瘤类型中,了解 BAF 复合物的基本生物学特性产生了激动人心的发现。例如,由发现独特的 ncBAF 成员 BRD9 推动的研究表明它是横纹肌瘤和滑膜肉瘤中的关键脆弱点 (13, 14)。
的确,对合成毁坏性的探索正迅速成为 BAF 研究的关注领域。肿瘤似乎需要相互排斥的同系物的一种功能成分,包括 Brg1/BRM 和 ARID1A/B (15,16)。在 BAF 突变肿瘤中,还依赖于其他非 BAF 相关蛋白,例如 PRC2 成员 Ezh2 (17)。随着 Ezh2 和 BET 抑制剂的广泛供应,寻找对抗 BAF 突变型癌症的联合疗法似乎充满了机遇。
虽然您细胞中的大量 DNA 确实是令人难困惑的,但最近的一连串研究为我们的细胞如何管理它提供了一些背景知识,同时也增进了我们对疾病状态和治疗策略的理解。
研究相关途径。
参考文献:
- 23644491
- 9671307
- 20826764
- 23540691
- 29861296
- 30078722
- 17640523
- 28824374
- 22426308
- 22426309
- 19279218
- 19279220
- 30397315
- 31015438
- 24520176
- 24562383
- 26552009





 沪公网安备31011502018823号
沪公网安备31011502018823号