衰老是一种细胞状态,在此状态下细胞保持代谢活性,但不可逆转地退出细胞周期,并且无法对诱导增殖的刺激做出反应。衰老细胞影响从癌症到糖尿病和老化的许多生理和病理过程。相应地,了解衰老为何会导致这些疾病可能会促使治疗一系列疾病的提前衰老疗法和抗衰老疗法的开发。
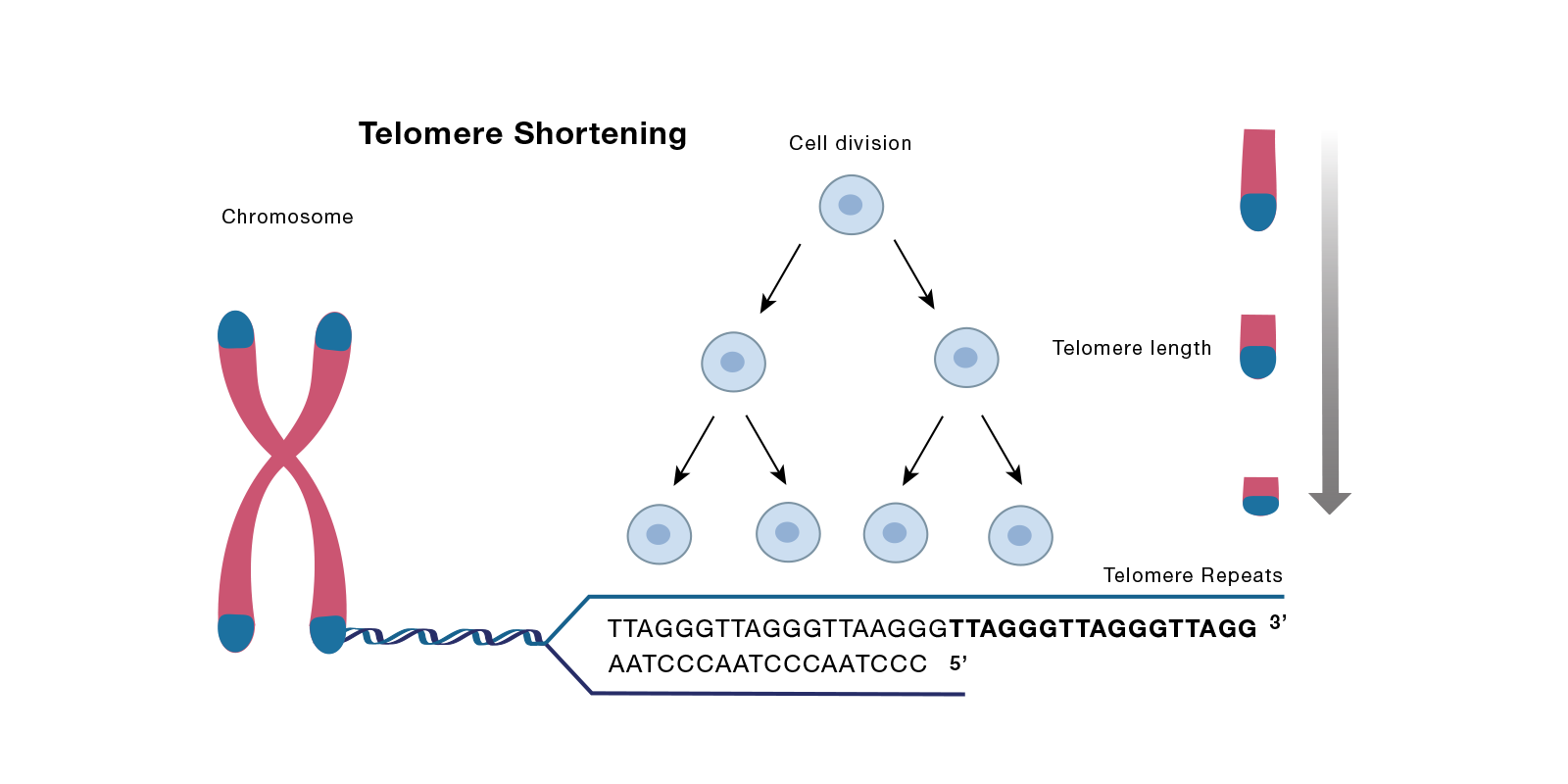
各种细胞外信号引起的 DNA 损伤和细胞内癌基因的激活是细胞衰老的主要启动因素。但是,由于端粒 DNA 的正常缩短,也可能导致衰老。数十年前,Leonard Hayflick 和 Paul Moorehead 报告了他们的开创性发现,即在体外生长的细胞在经历永久性细胞周期停滞之前具有连续的细胞分裂能力,这一过程称为复制衰老( Moorhead,1961年; PMID:13905658). 随后的工作表明,施加此限制的部分原因是由于染色体末端修整所产生的信号(称为端粒),在细胞分裂之前每轮 DNA 复制中都出现这种信号[(Bodnar AG,1998;PMID 9454332) 或以下评论(Kuilman T 2010,PMID 21078816)]。
端粒由成百上千的短重复核苷酸序列以及富含GT的单链突出端组成。这些序列被几个端粒结合蛋白识别和结合,这些蛋白质被称为 shelterin 复合体,它们有助于形成染色体帽,保护染色体末端不被降解。Shelterin 复合体由多种蛋白质组成,包括端粒重复因子 2 (TRF2)、端粒重复结合因子 2 相互作用蛋白(TERF2IP,也称为 RAP1)和端粒保护蛋白 (TPP1)。随着每一轮细胞分裂,端粒序列的长度缩短,这是因为染色体是 DNA 的线性链,其末端在复制过程中不能完全复制,这种现象被称为末端复制问题。当这些序列达到临界长度时,细胞 DNA 损伤修复机制被激活,进而导致细胞衰老。为了对抗这一过程,细胞表达一种叫做端粒酶的酶,它可以恢复端粒序列。然而,随着老化以及在端粒酶活性低的某些细胞类型中,随之而来的是复制性衰老。
许多类型的癌细胞部分通过上调端粒酶的表达和活性而表现出不受限制的增殖能力并逃脱复制性衰老。端粒酶与包括 dyskerin(DKC1)在内的蛋白质复合体协同作用,以在细胞分裂过程中合成端粒末端序列 de novo。MRE11-RAD50-NBS1 (MRN) 复合体在维持端粒稳定性方面也起着重要作用,并且编码该复合体的基因中的突变与某些癌症的风险增加相关。
衰老过程中,衰老细胞主要通过端粒缩短引起的复制衰老在组织中积累。因此,选择性靶向衰老细胞或增加端粒酶活性以限制复制性衰老的药物具有潜在的治疗价值,因为它们可以逆转衰老的有害作用并延长人类的寿命。实际上,由于端粒起着细胞时钟的作用,减缓其降解的方法可以通过限制细胞衰老来延长组织的健康和功能。
经历复制性衰老的细胞表现出许多与衰老相关的形态和代谢特征,从而导致对其他形式的 DNA 损伤的反应。因此,用于检测调节细胞周期停滞的蛋白质表达变化和衰老相关分泌表型(SASP)采用的测定法可用于检测其在各种实验模型中的存在。
有关端粒及其与细胞衰老之间关系的更多信息,请访问 CST 衰老信号转导通路。






 沪公网安备31011502018823号
沪公网安备31011502018823号