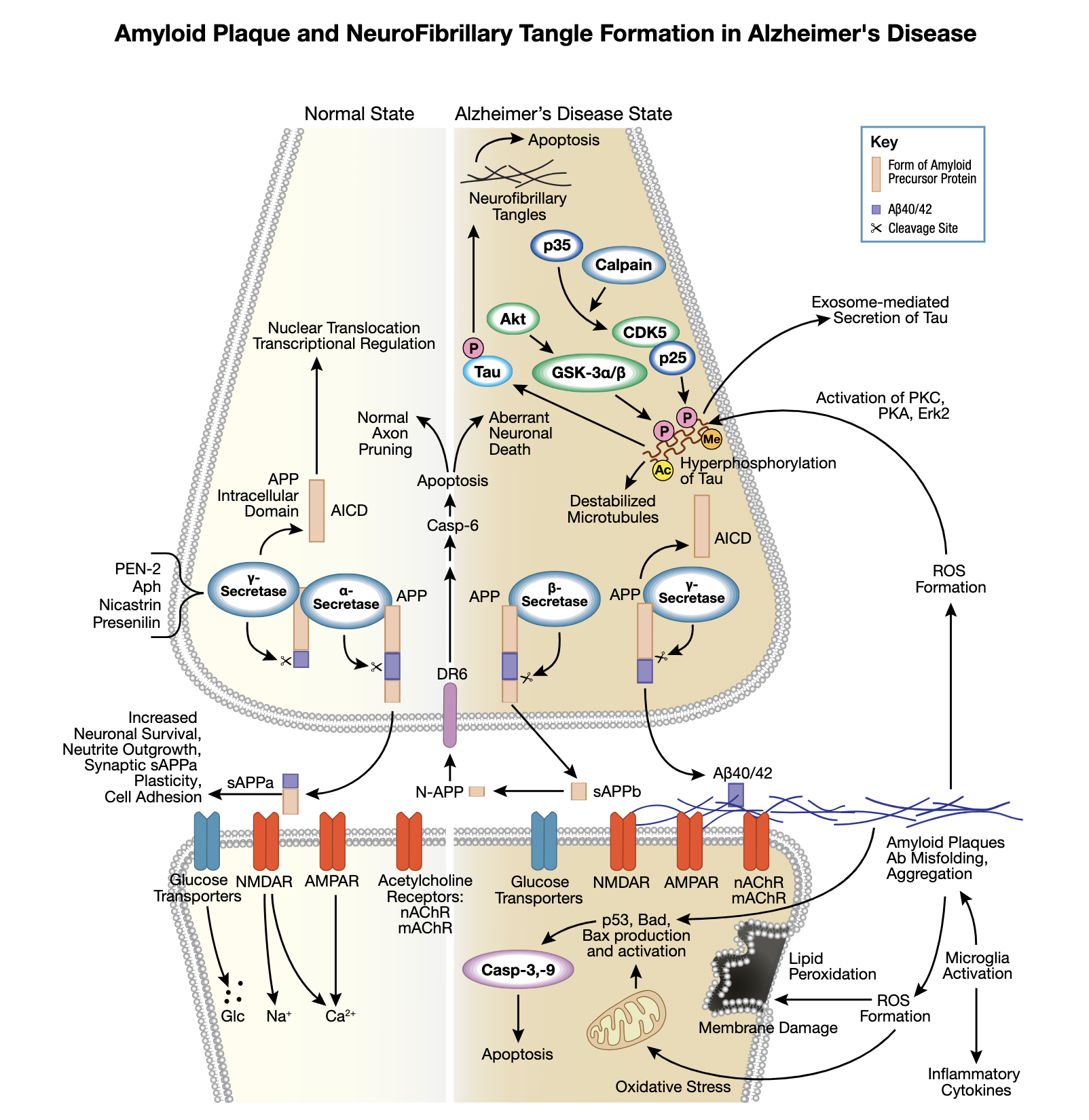
Tau 是一种主要在特定脑细胞中表达的微管相关蛋白,其作用是稳定轴突微管。Tau 蛋白存在 8 种不同的亚型,并且可在多个独特位点发生磷酸化修饰,这些修饰会降低其结合微管的能力。虽然 Tau 在健康的正常脑细胞中会发生磷酸化,而在阿尔茨海默病 (AD) 等神经退行性疾病中会呈现过度磷酸化状态。
Tau 蛋白和神经纤维缠结在阿尔茨海默病中的作用
在阿尔茨海默病中发现的神经纤维缠结是由Tau过度磷酸化所引起的。Tau 磷酸化会发生在许多位点上,通常被激酶 GSK3 和 CDK5 磷酸化,并且会导致结合微管的能力下降。
过度磷酸化会导致 tau 解离和随后的微管不稳定性以及 tau 低聚化。在阿尔茨海默病以及其他 tau 病变中观察到的神经纤维缠结是由过度磷酸化 tau 组成的成对螺旋纤丝的集合。有人认为,Tau 蛋白能够形成类朊病毒“种子”,通过这些“种子”,它能在神经元之间扩散,而神经纤维缠结的存在最终会导致神经元凋亡和进一步推动疾病发展。
监视磷酸化 Tau 和总 Tau
总 tau 和磷酸化 tau 的水平可用来辅助神经退化的诊治。例如,总 tau 和磷酸化 tau 是高度敏感的生物标记物,能够预测轻度认知障碍到阿尔茨海默病的进展。
tau 的磷酸化状态会显著影响蛋白的胞内分布。在海马神经元的神经元胞体以及永生化 GnRH 神经元中发现了磷酸化 tau。进一步证据表明,Tau 在 Ser404 位点上的磷酸化会破坏微管的稳定性,这说明阿尔茨海默病和 Ser404 位点的过度磷酸化之间的关联性。
抗体在 Tau 检测中的重要性
Tau 单克隆抗体旨在检测内源水平的 Tau 蛋白以及各种磷酸化的 Tau 蛋白,包括位点:Thr181、Ser199、Ser202、Thr205、Ser214、Thr231、Ser396、Ser404 和 Ser416。在蛋白印迹、免疫沉淀、免疫荧光和免疫组织化学实验中,可测定某种组织样品中聚集在神经纤维缠结中的 tau 的水平。
为了支持神经退化研究,Cell Signaling Technology 的科学家开发了大量能分析 tau 和磷酸化 tau 的抗体。






 沪公网安备31011502018823号
沪公网安备31011502018823号