神经炎症是小胶质细胞和星形胶质细胞在中枢神经系统(CNS;大脑和脊髓)中激活免疫反应。通常,在 CNS 损伤、感染、毒素的刺激下或在自身免疫的作用下会出现神经炎症。瞬时神经炎症信号转导在发育和损伤后组织修复期间起到保护作用,而慢性神经炎症与阿尔茨海默病、帕金森病、肌萎缩性脊髓侧索硬化症和多发性硬化等神经退行性疾病的进展有关。与神经退化有关的病理性神经炎症主要由小胶质细胞介导,小胶质细胞是 CNS 的常驻型免疫细胞。
错误折叠蛋白的聚集是许多神经退行性疾病的一种标志,并且会导致细胞毒性。大多数蛋白折叠错误都会导致功能获得性或显性失活效果。小胶质细胞能感应并内化错误折叠的蛋白,从而促进清除,但在神经退行性疾病状态下,这个过程会出现失调,从而导致神经炎症。
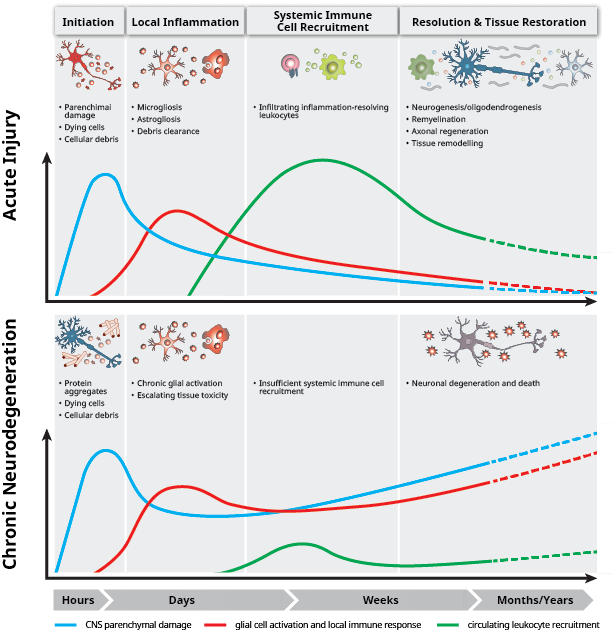
中枢神经系统 (CNS) 和免疫系统相互作用
星形胶质细胞和小胶质细胞在 CNS 中起到重要的免疫调节作用。尤其是,小胶质细胞在感应环境变化、应对有害刺激以及吞噬碎片和凋亡神经元方面起到重要作用。通过将抗原呈递给 T 淋巴细胞,小胶质细胞还介导免疫系统和 CNS 之间的交互作用。此外,小胶质细胞以及星形胶质细胞和神经元还会释放能够促进或抑制神经炎症的可溶性因子。
神经元、星形胶质细胞和小胶质细胞在神经退行性疾病中的作用
神经元能处理电化学信号,因此是 CNS 中接收和传送电脉冲的主要细胞。根据神经元特异性烯醇化酶 (NSE)、微管相关蛋白 2 (MAP2) 和神经元特异性胞核蛋白 (NeuN) 的表达可区分成熟的神经元。通常,NeuN 的表达下降(指示神经元丢失)可确定神经炎症的程度。
除了神经元之外,神经胶质细胞(星形胶质细胞和小胶质细胞)通过监测突触稳态和促进凋亡细胞的清除,发挥主要的免疫调节作用。
作为脑中的常驻型免疫细胞,小胶质细胞表达结合离子钙的接头蛋白分子 1 (IBA1)、整合素 α M (ITGAM/CD11b) 及 CD68(小鼠 F4/80)。IBA1 表达可用来区分小胶质细胞与浸润性单核细胞,并且经证实会在神经炎症条件下表达。
成熟星形胶质细胞最具特异性的标记物是胶质纤维酸性蛋白 (GFAP) 和 S100β 表达。GFAP 表达升高表明星形胶质细胞被激活,说明存在炎症反应。
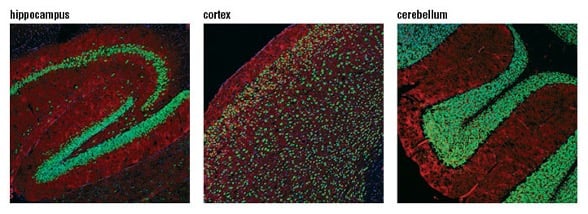
使用 NeuN (D4G4O) XP® Rabbit mAb(绿色)对小鼠海马体(左图)、皮层(中图)和小脑(右图)进行共聚焦免疫荧光分析。肌动蛋白丝用 DyLight™ 554 Phalloidin #13054(红色)标记。伪彩蓝色 = DRAQ5® #4084(DNA 荧光染料)。
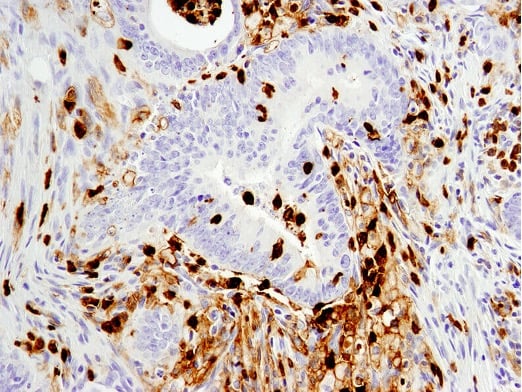
使用 CD11b/ITGAM (D6X1N) Rabbit mAb #49420 对石蜡包埋的人结肠癌细胞进行免疫组织化学分析。
神经退化中的信号转导
现已检测到多种与神经退化有关的主要信号转导通路,这些信号转导通路与发育和衰老(表观遗传学、端粒)有关,并且还会影响局部组织环境和循环(细胞黏附和炎症)以及胞内机制(凋亡和线粒体功能障碍)。
相关: 相互作用的神经退行性通路图
初期损伤、创伤或遗传缺陷都会导致脑出现炎症信号转导。常驻型免疫细胞(星形胶质细胞和小胶质细胞)会启动能导致 TNFα、IL-1β 和 IL-6 等细胞因子分泌的炎症反应。
小胶质细胞激活的一种关键调节分子是在骨髓细胞 2 上表达的触发受体 (TREM2),这是一种在小胶质细胞上表达的蛋白,负责脑中的小胶质细胞存活并调节炎症反应。在健康状态下,TREM2 会传递促炎性细胞因子的信号在一定程度上起到神经保护作用,从而限制神经炎症。尽管 TREM2 信号转导在炎症、淀粉样蛋白吞噬、斑块包囊以及凋亡细胞清除中起到作用,但 TREM2 的哪种功能在神经退化中起到最大作用尚不清楚。在疾病状态方面,TREM2 突变与 AD 风险增加有关。
炎症小体是胞质多蛋白复合体,暴露在病原体相关分子模式 (PAMP) 或危险相关分子模式 (DAMP) 下之后会引起天然免疫应答。这些结构均与神经退行性疾病有关,尤其是 NLRP3 炎症小体,它会通过激活 IL-1β 和 IL-18 成为神经炎症的一个关键病因。
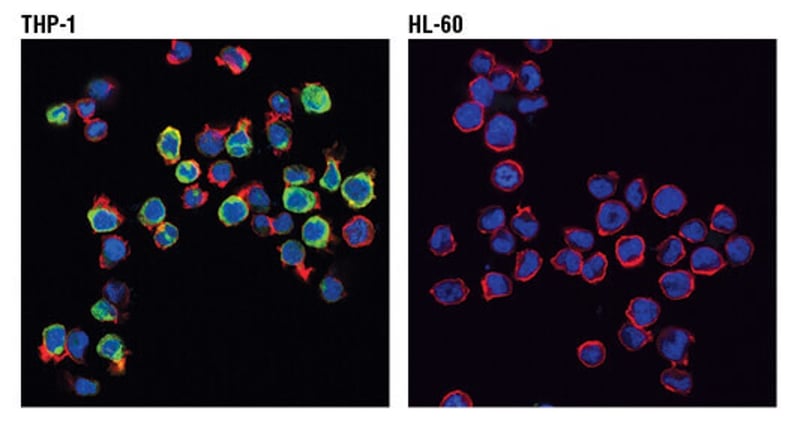
使用 TREM2 (D8I4C) Rabbit mAb #91068(绿色)对 THP-1(阳性,左图)和 HL-60(阴性,右图)进行共聚焦免疫荧光分析。肌动蛋白丝用 DyLight™ 554 Phalloidin #13054(红色)标记。伪彩蓝色 = DRAQ5® #4084(DNA 荧光染料)。






 沪公网安备31011502018823号
沪公网安备31011502018823号