细胞识别外部信号提示(配体和营养物质)并对快速变化的环境适当反应的能力,涉及细胞主要信号转导网络之间的交互作用。1,2这些复杂的通路感知胞内营养物质、代谢通量和应激,并通过众多下游效应分子整合这些不同的信号。1,2作为一名科学家,我发现试图理解通路的错综复杂本质(它们在何处重叠和交汇)是一个待梳理的有趣谜题。
在众多相互交织的信号转导通路中,我最感兴趣的是 PI3K/Akt 信号转导通路。我叫 Srikanth Subramanian,是 Cell Signaling Technology 的高级产品科学家。我是负责制备和管理所有 PI3K/Akt 抗体以及一些下游通路靶标的团队成员,所以,我可能会有些偏颇!
我与 PI3K/Akt 信号转导通路的渊源早在我加入 CST 之前,作为研究生时便已开始,并且一直持续到今天。研究和处理这个信号转导通路中的靶标,不仅让我在个人层面建立了持久的友谊,也在专业层面开展了大量的合作,留下了许多宝贵的回忆,并在我的职业生涯中发挥了重要作用。“PI3K/Akt 信号转导通路一直是我的兴趣所在,因为我逐渐意识到,家族中出现的一些疾病与这个动态通路中的特定蛋白质密切相关。”接下来,我将详细讲述其中一些蛋白质以及它们与我家族成员之间的个人联系。
PI3K/Akt 信号转导通路
PI3K/Akt 通路响应于胞外信号而促进代谢、增殖、细胞存活、生长和血管生成。1-2 这由一系列下游靶标的丝氨酸和/或苏氨酸磷酸化介导。2
PI3K/Akt 信号转导

查看交互式 PI3K/Akt 信号转导通路图,探索 CST® 抗体产品。
该通路已成为生物学和医学等众多领域中无数研究的焦点。1我们对进入 AKT (PI3K) 的上游调控性输入以及扩展 AKT 功能的关键多功能下游信号转导靶标(如 GSK3、FoxO、mTORC1)的理解已取得极大进展,AKT 在几乎所有细胞和器官系统中普遍存在。1鉴于 AKT 信号转导作用影响各种病理,包括但不限于癌症、胰岛素抵抗和 2 型糖尿病、自身免疫性疾病和神经系统疾病,我们对 AKT 调控及其功能的理解就尤为重要。1-3
胰岛素受体 (InsR)
2 型糖尿病(我的阿姨和祖母)
胰岛素受体 (InsR) 是一种异二聚体膜受体酪氨酸激酶,由二硫键连接在一起的两个细胞外 α 亚基(包含配体结合结构域)和两个 β 亚基(包含一个细胞外结构域、一个跨膜结构域和一个胞质酪氨酸激酶结构域)组成。4-8长 (InsR-β) 和短 (InsR-α) 同工型的生理作用持续演变,但似乎由对胰岛素样生长因子 (IGF)(尤其是 IGF-II)的不同结合亲和力决定。5-7 IR-α 主要在产前期间表达,其间它在胚胎发生和胎儿发育期间增强 IGF-II 的作用。6值得注意地,IR-α 也在成人组织中、尤其脑中表达。InsR-α 增加对 IGF-II 和胰岛素的敏感性。5-7另一方面,IR-β 主要在分化良好的成人组织(包括肝脏、肌肉、脂肪组织和肾脏)中表达,在那里它增强胰岛素的代谢作用。5-6
胰岛素受体信号转导通路

查看交互式胰岛素受体信号转导通路图,探索 CST® 抗体产品。
胰岛素是人体内能量稳态的重要操纵因子。8胰岛素控制功能受损会破坏能量平衡,导致诸如 2 型糖尿病等疾病。8,9对靶标细胞的控制始于激活细胞表面的胰岛素受体,并借助胞内信号转导网络(包括 PI3K 和 Akt)级联放大到不同的细胞过程,例如葡萄糖摄取(通过葡萄糖转运蛋白 GLUT4)和蛋白质合成。8-9在 2 型糖尿病中,GLUT4 的表达或转运至细胞外周膜的缺陷妨碍了葡萄糖的进入,从而影响细胞的能量生产。9
磷酸肌醇 3-激酶 (PI3K)
乳腺癌(我的两个阿姨)
PI3K/AKT 通路是乳腺癌中被最频繁增强的致癌通路。3,10乳腺正常发育受多种激素和信号转导通路控制。3,10它们包括雌激素受体信号转导、HER2(人类表皮生长因子受体 2)信号转导和典型 Wnt 信号转导以及 CDK(细胞周期蛋白依赖性激酶)、Notch、Sonic Hedgehog (SHH)、PI3K/Akt/mTOR 等。3,10-11PI3K 由以下两个结构域组成:催化性结构域 P110 和调控性结构域 P85。3,10在 PI3K 增强的诸机制当中,最频繁观察到 PIK3CA 基因突变(编码 P110a),连同 PTEN 蛋白质丢失,PTEN 是一种通常作用于 PI3K 的底物以逆转其活性的磷酸酶。3除了 PIK3CA 突变之外,还有许多其他可能增强 PI3K 活性的分子变化,例如 HER2 扩增、PTEN(磷酸酶和张力蛋白同源物)功能障碍和 AKT1(哺乳动物基因组中保守的三种 AKT/PKB 同工型之一)激活性突变。3,10-11
非霍奇金淋巴瘤(我最好的朋友)
PI3K 家族分为三个不同类别(I、II 和 III)。I 类与细胞生长和存活最相关,包括四个同工型:α、β、δ 和 γ。12,13PI3Kδ 和 γ 表达主要限于白细胞,而 PI3Kα 和 -β 则普遍表达。13PI3Kα 是胰岛素信号转导所需的主要同工型,它也已在各种淋巴瘤中鉴定到,这提示 PI3Kα 在淋巴瘤形成中的作用。13-16PI3Kβ 同工型有助于调节整合素的形成和稳定性,并且是血小板活化所必需的。6-8PI3Kδ 和 -γ 调节白细胞运输和细胞增殖。13-16
在 B 细胞非霍奇金淋巴瘤 (NHL) 中, PI3K α 和 -δ 抑制作用的组合是抑制磷酰-AKT 以及下游 NF-kβ 和 PI3K 通路靶标所必需的。13-16
间质性肺病/肺纤维化(我母亲和叔叔)
肺损伤可以通过多种机制发生,但这些机制的共同点是不可控和进展性纤维化。17 I 型胶原主要存在于人类肺纤维化组织中。17正常生理条件下,肺成纤维细胞与 I 型胶原细胞外基质 (ECM) 相互作用时,PTEN 抑制 PI3K/Akt 激活,导致抑制成纤维细胞增殖并刺激细胞凋亡。17特发性肺纤维化 (IPF) 成纤维细胞由于 PTEN 抑制而增强 PI3K/AKT 活性,从而导致 IPF 成纤维细胞在胶原基质上具有高度增殖/抗细胞凋亡性。17
糖原合成激酶-3 (GSK-3)
神经退行性疾病(我妻子的祖母)
糖原合成激酶-3 (GSK-3) 是一种细胞丝氨酸/苏氨酸蛋白激酶,它调控多种细胞过程,包括细胞增殖、分化和黏附。18-19已鉴定出 GSK-3 的两种同工型,即 GSK-3α 和 GSK-3β,它们在整个大脑中普遍表达 (18)。GSK-3 受 Akt 激活过程调控。GSK-3 的活性取决于特定位点处的磷酸化;GSK-3β 的 Ser9 磷酸化或 GSK-3α 的 Ser21 磷酸化抑制活性,而 GSK-3β 的 Tyr216 磷酸化和 GSK-3α 的 Tyr279 磷酸化则增加活性。18-19
GSK-3 失调与诸如阿尔茨海默病 (AD) 和帕金森病 (PD) 等疾病的发病机制有关。18-19 GSK-3 与 tau、β-淀粉样蛋白 (Aβ) 和 α-突触核蛋白相互作用,而已经对这些蛋白质参与神经退行性疾病的情况研究多年。Aβ 产生受 GSK-3 控制,其毒性由 GSK 诱导的 tau 磷酸化和变性介导。19α-突触核蛋白是 GSK-3 的底物。GSK-3 抑制作用防范帕金森病相关毒素。18-19
FoxO1 和 FoxO3a
自身免疫性疾病/狼疮(我母亲)
叉头框 O 类 (FoxO) 转录因子家族参与代谢、凋亡、氧化应激抗性和衰老。20-21在哺乳动物中,有四种 FoxO 蛋白,即 FoxO1、FoxO3a、FoxO4 和 FoxO6。FoxO1、FoxO3 和 FoxO4 在多种组织中广泛表达,而 FoxO6 主要在神经细胞中表达。1-2,21当 FoxO1 和 FoxO3a 处于活性状态时,它们是核蛋白,但在 Akt 激活后,FoxO1 和 FoxO3a 被磷酸化、失去活性并被转运到细胞质中。20-23
FoxO 家族成员在免疫调节中发挥着关键作用,不过它们的功能可能广泛,有时甚至相互矛盾;20-21FoxO1 可以激活 NF-κB,但 FoxO3a 和 FoxO4 可能通过抑制 NF-κB 活性,在自身免疫和炎症疾病中发挥抑制作用。21-23在系统性红斑狼疮 (SLE) 中,淋巴细胞活化/过度活跃受 T 细胞受体和 B 细胞受体下游的 FoxO1 信号调节,并推动免疫发病机制。20 FoxO3a 在 SLE 病程中下调。21
mTOR 信号转导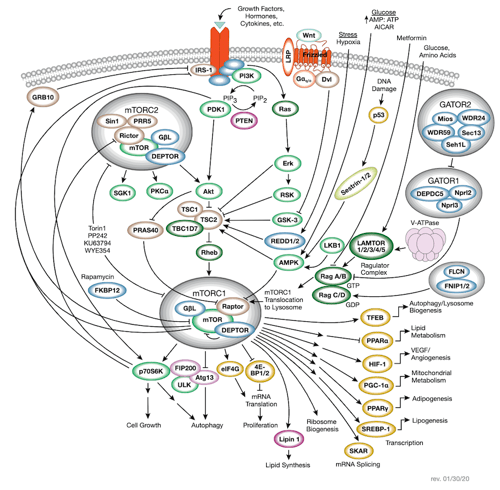
查看交互式 mTOR 信号转导通路图,探索 CST® 抗体产品。
TSC-mTORC1
自身免疫性疾病/狼疮(我母亲)
哺乳动物雷帕霉素靶标 (mTOR) 是一种在细胞生长和代谢调节中起着中心作用的保守丝氨酸/苏氨酸激酶 (24)。mTOR 可掺入 mTOR 复合体 1 (MTORC1) 或 mTOR 复合体 2 (MTORC2) 中;每个复合体的组分在结构上相似,但在功能上不同。25 mTORC1 是营养和代谢之间的主要连接点,感知营养素、生长因子及环境应激。24,25 mTORC2 参与 Akt的表达和激活。25
结节性硬化症复合物 (TSC) 是一种由 TSC1 和 TSC2 组成的肿瘤抑制因子。24,25 TSC 通过调节转录或转而调节自噬来影响细胞代谢。25 在不利条件下,AMP 活化蛋白激酶 (AMPK) 使 TSC2 磷酸化并促进 TSC1-TSC2 复合物形成,从而抑制 mTORC1 活性 (24-25)。AKT 介导的磷酸化抑制 TSC2 并解除这种抑制作用以激活 mTORC1。1,25
持续激活 mTORC1 导致 Akt 去磷酸化,这抑制 mTORC1 的反馈。25这样,mTORC1 既是 Akt 的下游激活靶标,又通过对 Akt 的负反馈作用成为通路抑制物。1,24,25
血浆细胞/浆细胞分泌针对传染性病原体的保护性抗体,但它们还产生在系统性红斑狼疮 (SLE) 等自身免疫性疾病中靶向身体细胞的致病性抗体(自身抗体)(26)。mTORC1 过度激活可能导致浆细胞和自身抗体产生增多,可能增强发病机制。24-26
解决 PI3K/Akt 谜题的线索
鉴于 PI3K/Akt 信号转导的范围广泛,Akt 在各种细胞类型和组织响应于各种刺激中发挥核心而多样形作用,这并不令人意外。1-2然而,重要的是谨记 PI3K/Akt 通路是更庞大信号转导网络的不可分割部分,并且所有信号传导均有背景且是动态变化的。在病理学方面,研究科学家和医学专家正在摆弄棋盘游戏的信号转导版“线索”。他们每天都在问一些问题,比如:谁是病理性元凶?使用了哪种(些)靶标信号转导机制?在哪些细胞或器官系统中?
随着阐明复杂信号转导网络的竞赛持续进行,科学家持续地需要研究工具帮忙。这就是 Cell Signaling Technology 解开谜题的地方。我们公司的使命就是生产最相关、最有用、最具可重复性的癌症研究和转化研究产品。我们致力于为科学界提供可靠的信号转导工具,帮助研究人员管理和操纵这些信号转导网络,希望有一天能够治疗困扰着我们生命中所有爱人的疾病。
20-CEP-97405
参考文献:
- Manning BD, Toker A. AKT/PKB Signaling: Navigating the Network. Cell. 2017 Apr 20; 169(3): 381–405.
- Martini, Miriam & De Santis, Maria & Braccini, Laura & Gulluni, Federico & Hirsch, Emilio. (2014). PI3K/AKT Signaling pathway and cancer: An updated review. Annals of medicine. 46. 1-12
- Feng Y, Spezia M, Huang S, Yuan C, Zeng Z, Zhang L, Ji X, Liu W, Huang B, Luo W, Liu B, Lei Y, Du S, Vuppalapati A, Luu HH, Haydon RC, He TC, Ren G. Breast cancer development and progression: Risk factors, cancer stem cells, signaling pathways, genomics, and molecular pathogenesis. Genes Dis. 2018 May 12;5(2):77-106.
- Yip, C.C. and Ottensmeyer, P. (2003) J Biol Chem 278, 27329-32.
- Antonino Belfiore, Francesco Frasca, Giuseppe Pandini, Laura Sciacca, Riccardo Vigneri, Insulin Receptor Isoforms and Insulin Receptor/Insulin-Like Growth Factor Receptor Hybrids in Physiology and Disease, Endocrine Reviews, Volume 30, Issue 6, 1 October 2009, Pages 586–623.
- Belfiore A, Malaguarnera R, Vella V, Lawrence MC, Sciacca L, Frasca F, Morrione A, Vigneri Insulin Receptor Isoforms in Physiology and Disease: An Updated View. Endocr Rev. 2017 Oct 1;38(5):379-431.
- Escribano O, Beneit N, Rubio-Longás C, López-Pastor AR, Gómez-Hernández A. The Role of Insulin Receptor Isoforms in Diabetes and Its Metabolic and Vascular Complications. J Diabetes Res. 2017;2017:1403206.
- Lizcano J. M. Alessi D. R. (2002) The insulin signaling pathway. Curr Biol. 12, 236-238.
- Alam F, Islam MA, Khalil MI, Gan SH. Metabolic Control of Type 2 Diabetes by Targeting the GLUT4 Glucose Transporter: Intervention Approaches. Curr Pharm Des. 2016;22(20):3034-3049.
- Mukohara T. PI3K mutations in breast cancer: prognostic and therapeutic implications. Breast Cancer (Dove Med Press). 2015;7:111‐123.
- Nwabo Kamdje A.H., Seke Etet P.F., Vecchio L., Muller J.M., Krampera M., Lukong K.E. Signaling pathways in breast cancer: therapeutic targeting of the microenvironment. Cell Signal. 2014;26(12):2843–2856.
- Thorpe LM,Yuzugullu H, Zhao JJ. PI3K in cancer: divergent roles of isoforms, modes of activation and therapeutic targeting. Nat Rev Cancer. 2015; 15: 7-24.
- Batlevi CL, Younes A. Revival of PI3K inhibitors in non-Hodgkin’s lymphoma. Annals of Oncology. 2017; 28(9): 2047-2049.
- Curran E, Smith SM. Phosphoinositide 3-kinase inhibitors in lymphoma. Curr Opin Oncol. 2014 Sep;26(5):469-75.
- Schatz, J.H. Targeting the PI3K/AKT/mTOR Pathway in Non-Hodgkin’s Lymphoma: Results, Biology, and Development Strategies. Curr Oncol Rep 13, 398 (2011).
- Blachly, J.S. and Baiocchi, R.A. (2014), Targeting PI3‐kinase (PI3K), AKT and mTOR axis in lymphoma. Br J Haematol, 167: 19-32.
- Lawrence J, Nho R. The Role of the Mammalian Target of Rapamycin (mTOR) in Pulmonary Fibrosis. Int J Mol Sci. 2018 Mar 8;19(3):778.
- Lei P, Ayton S, Bush AI, Adlard PA. GSK-3 in Neurodegenerative Diseases. Int J Alzheimers Dis. 2011:189-246.
- Kockeritz L, Doble B, Patel S, Woodgett JR. Glycogen synthase kinase-3--an overview of an over-achieving protein kinase. Curr Drug Targets. 2006 Nov; 7(11):1377-88.
- Hritzo Ahye MK, Golding A. Cytoplasmic FOXO1 identifies a novel disease-activity associated B cell phenotype in SLE Lupus Science & Medicine 2018;5:e000296.
- Lu M, Xu W, Gao B, Xiong S. Blunting Autoantigen-induced FOXO3a Protein Phosphorylation and Degradation Is a Novel Pathway of Glucocorticoids for the Treatment of Systemic Lupus Erythematosus. J Biol Chem. 2016 Sep 16;291(38):19900-12.
- Lin L, Hron JD, and Peng SL. (2004). Regulation of NF-κB, Th activation, and autoinflammation by the forkhead transcription factor Foxo3a. Immunity 21, 203–213.
- Zhou W, Cao Q, Peng Y, Zhang QJ, Castrillon DH, DePinho RA, and Liu ZP. (2009) FoxO4 inhibits NF-κB and protects mice against colonic injury and inflammation. Gastroenterology 137, 1403–1414.
- He J, Ma J, Ren b, Liu A. Advances in systemic lupus erythematosus pathogenesis via mTOR signaling pathway. Semin Arthritis Rheum. 2020 Apr;50(2):314-320.
- Stylianou K, I Petrakis, V Mavroeidi, S Stratakis, E Vardaki, K Perakis, et al. The PI3K/Akt/mTOR pathway is activated in murine lupus nephritis and downregulated by rapamycin. Nephrol Dialysis Transplant, 26 (2) (2011), pp. 498-508.
- Malkiel S, Barlev AN, Atisha-Fregoso Y, Suurmond J, Diamond B. Plasma Cell Differentiation Pathways in Systemic Lupus Erythematosus. Front Immunol. 2018 Mar 5;9:427.






 沪公网安备31011502018823号
沪公网安备31011502018823号