应激颗粒 (SG) 是细胞在应激反应中形成的重要防御机制,帮助细胞暂停蛋白质生产并保护关键转录本。通常情况下,应激消除后这些颗粒会自行解离。但当该调控过程出现异常时,蛋白质可能发生异常聚集并形成毒性聚集体。
 |
探索 CST 的相关抗体和小包装组合: • G3BP1 (E9G1M) XP® Rabbit mAb #61559 |
|
这篇文章探讨了应激颗粒的形成机制、其特异性定位蛋白(可作为关键分子标记物)以及它们在多种神经退行性疾病中的作用。
什么是应激颗粒?
最初在番茄细胞中发现的应激颗粒是细胞浆中响应于各种细胞应激源而形成的微小 (0.1 – 4 µm)、不规则形灶斑。应激颗粒含有蛋白质与核糖核苷酸的复杂混合物,其形成过程在从酵母到人类等多种物种中都具有高度保守性。SG 组装据信是一种响应于应激的保护性适应,因而蛋白质翻译停顿、未翻译的mRNA转录物遭隔离,并优先翻译应激反应转录物SG 的形成短暂,并且一旦应激源移除,它们就迅速解体。
以下延时视频详细地突出反映了这一动态过程:1
NaAsO2 应激期间的应激颗粒组装。将表达 GFP-G3BP1 的 U-2 OS 细胞暴露于 NaAsO2 (0.5 mM) 并成像 20 分钟。使用 100X 物镜在旋转圆盘共聚焦显微镜上按 20 秒间隔采集图像。
SG 是一个类型的生物分子凝聚物,也称为无膜细胞器 (MLO)。其他充分研究的 MLO 包括核仁、Cajal 体、核斑点和加工体(P 体)。MLO 是缺少双层膜下区室化的亚细胞灶斑且通常由 RNA 结合蛋白 (RBP) 和核糖核苷酸组成。招募到 MLO 的许多 RBP 包含固有无序区域 (IDR),这些区域为富含甘氨酸与不带电极性残基的低复杂度、非结构化区域。
由于其化学性质独特,IDR 可以彼此形成众多弱静电相互作用,从而允许含 IDR 的蛋白质在胞质溶胶内部缔合并分离成明显的流体小滴。认为这个分离成流体小滴的过程(更通常称为液-液相分离 (LLPS))是形成 SG 和大多数其他 MLO 背后的驱动力。为了更直观地理解 LLPS,请想象油在一杯水中分离成液滴。
如何形成应激颗粒?
如前所述,SG 响应于各种生物应激源和非生物应激源形成,这些 SG 转而导致 eIF2 蛋白在丝氨酸 51 上磷酸化。取决于应激类型,这种公认的磷酸化事件由四种不同的上游激酶介导:
-
PKR 针对病毒感染
-
PERK 针对 ER 应激
-
GCN2 针对饥饿/营养剥夺
-
HRI 针对氧化或渗透应激。2
一旦发生磷酸化,eIF2 不再能将 GDP 交换为 GTP,导致蛋白质翻译停滞和 40S 小核糖体亚基界面、未翻译的 mRNA 与翻译起始因子暴露。这种暴露的预启动复合体 (PIC) 充当募集 SG 相关蛋白并最终组装 SG 的“种子”。3
关键标记物:哪些蛋白质定位至应激颗粒?
目前,已鉴定出 400 多种定位至应激颗粒的不同蛋白质。4 对于其中许多蛋白质,募集取决于多种因素,包括诱导的应激类型、疾病状态和正在研究的细胞系/组织。
在这里,我们重点介绍 SG 组装所需的一些主要蛋白质:
G3BP1 和 G3BP2
首批招募至 mRNA 翻译停滞部位的蛋白质之一是 G3BP1,一种最初认为与 RasGAP 结合的 55 kDa RBP。然而,我们现在知道 G3BP1 是 SG 组装的关键介导因子之一,如果不是关键介导因子本身的话。在胞质溶胶中,G3BP1 通过其位于氨基酸 340-415 内部的 RNA 识别基序 (RRM) 与未翻译的 mRNA 相互作用。
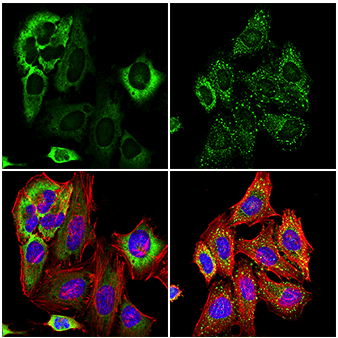 使用 G3BP1 (E9G1M) XP® Rabbit mAb(绿色)对未经处理(左图)或经亚砷酸钠(500 μM,30 分钟;右图)处理的 HeLa 细胞进行共聚焦免疫荧光分析。肌动蛋白丝用 DyLight 554 Phalloidin #13054(红色)标记。将样品封装在 ProLong Gold Antifade Reagent with DAPI #8961(蓝色)中。注:血清饥饿或亚砷酸钠处理后G3BP1 转位和应激颗粒形成。
使用 G3BP1 (E9G1M) XP® Rabbit mAb(绿色)对未经处理(左图)或经亚砷酸钠(500 μM,30 分钟;右图)处理的 HeLa 细胞进行共聚焦免疫荧光分析。肌动蛋白丝用 DyLight 554 Phalloidin #13054(红色)标记。将样品封装在 ProLong Gold Antifade Reagent with DAPI #8961(蓝色)中。注:血清饥饿或亚砷酸钠处理后G3BP1 转位和应激颗粒形成。
一旦与 RNA 结合,G3BP1 就通过其多重 IDR 招募并相互作用于各种其他 SG 相关蛋白,这也促进相分离。仅 G3BP1 的瞬时过表达就足以诱导 SG 形成,即使在没有细胞应激源的情况下,也突出了其在此过程中的关键功能。5,6 G3BP1 水平降低会导致应激反应中形成的 SG 数量和大小减少;然而,G3BP1 及其旁系同源物 G3BP2 的双敲除突变完全消除了亚砷酸盐诱导的 SG 形成。5,7,8,9 虽然目前对 G3BP2 了解较少,但据信就 SG 组装方面而言,它与 G3BP1 共享大量冗余功能。8
TIA-1 和 TIAR
TIA1 和 TIAR 是另一对通常与 SG 缔合的相关 RBP。一旦应激诱导,TIA1/R 就从胞核转位至胞质 SG,在那里据信它们连同 G3BP1/210 一起形成 SG“核心”。TIA1/R 包含三个与未翻译的 mRNA 相互作用的 N 端 RRM,以及一个相分离和 SG 形成所必需的 C 端朊病毒样结构域 (PLD)。11 与 G3BP1 一样,仅 TIA1 的过表达就足以诱导 SG 在没有应激的情况下形成。10
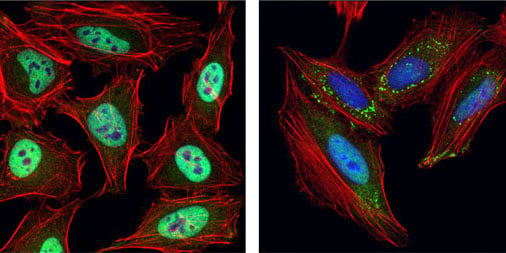
使用 TIAR (D26E4) Rabbit mAb #8611(绿色)对未经处理(左图)或经紫外线(右图)处理的 HeLa 细胞进行共聚焦免疫荧光分析。肌动蛋白丝用 DyLight 554 Phalloidin #13054(红色)标记。蓝色 = DRAQ5 #4084(荧光 DNA 染料)。注:紫外线处理后 TIAR 转位和应激颗粒形成。
其他蛋白质标记物
许多其他值得注意的蛋白质被招募至并参与 SG 调节,包括 FMR1/FMRP、PABPC1、ataxin-2、caprin1 和 UBAP2L。UBAP2L 有特殊意义,因为它可能在 G3BP1/2 上游的 SG 形成中发挥作用;这一新发现凸显了进一步研究 SG 组装动力学的必要性。13
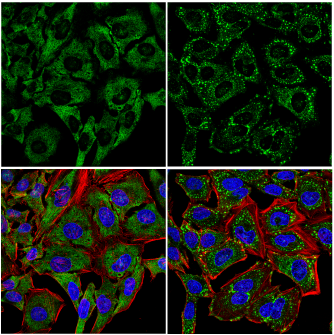
使用 UBAP2L (E5X4E) Rabbit mAb(绿色)对未经处理(左图)或经亚砷酸钠(500 μM,30 分钟;右图)处理的 HeLa 细胞进行共聚焦免疫荧光分析。肌动蛋白丝用 DyLight 554 Phalloidin #13054(红色)标记。蓝色 = DRAQ5 #4084(荧光 DNA 染料)。注:亚砷酸钠处理后 UBAP2L 转位和应激颗粒形成。
神经退行性病变中的应激颗粒
正常情况下,应激颗粒的形成是一个短暂、可逆过程;当应激消散时,SG 解体通过招募多种自噬促进蛋白(如 VCP 和 SQSTM1)实施。然而,由于高浓度的蛋白质-蛋白质相互作用,如果解体过程遭破坏,则 SG 尤其易于形成毒性蛋白质聚集物。SG 从可溶性液相混合物到不溶性固相聚集物的这种转变可以充当胞质包涵体形成的种子,胞质包涵体形成是各种神经退行性疾病的界定性特征。
TDP43 是一种参与转录调控和外显子剪接的 RNA 结合蛋白,是与肌萎缩侧索硬化 (ALS) 相关的主要病理蛋白。TDP43 蓄积也与阿尔茨海默病 (AD) 和额颞叶痴呆 (FTD) 有关。TDP43 中的疾病相关突变可促进 SG 的生物物理特性发生无数变化,例如 TDP43 从胞核错误定位到胞质应激颗粒,增加 SG 的大小和数量,以及 SG 向病理性包涵体的转化。14,15,16,17
FUS 是另一种在转录调节、前体 mRNA 剪接和 DNA 损伤反应中发挥作用的 RNA 结合蛋白。与 TDP43 一样,已在多种神经退行性疾病中确定含 FUS 的蛋白质聚集物病理性蓄积。FUS 的突变常见于 ALS 患者和 FTD 患者中,通常发生在该蛋白质的 C 末端核定位序列内部。这些突变导致主要在胞核的蛋白质错误定位到细胞浆中,并且因此促进 FUS 聚集物在胞质应激颗粒中积累。18
虽然微管相关蛋白 tau 未被视为传统 RBP,但也已被证明与 RNA 结合,并与多种 SG 相关蛋白(包括 TIA1、ataxin-2 和 PABPC1)共定位。19,20 Tau 也可以发生 LLPS,这在 RNA 存在的情况下会得到增强;然而,tau 并不会独立于 SG 形成 RNA 颗粒。这表明 tau 通过与 mRNA 和 RBP 的相互作用招募到 SG,在那里它可能潜在形成不溶性 tau 聚集物。Tau 过度磷酸化也可能影响其向 SG 的募集。20
未来研究
应激颗粒是一种独特而迷人的生理适应,它允许细胞通过一系列与液-液相分离偶联的细胞信号转导事件对蛋白质翻译的变化做出反应。这是一个令人兴奋的研究领域,未来的研究可能会提供关于 SG 组装/解体、招募到这些灶斑的新组分及它们与人类疾病相关性的新信息。将 SG 与诸如 ALS 和 FTD 等神经退行性疾病联系起来已经取得巨大进展,针对 SG 蛋白错误折叠和聚集的潜在疗法可能用于治疗这些疾病。
其他资源:
- 关于应激颗粒的额外信息,请参阅我们的交互式应激颗粒生命周期图。
- 对其他 MLO 感兴趣?索取一份生物分子凝聚物凝标记物海报。
- 查看交互式阿尔茨海默病信号转导通路。
- 下载手册:神经退变的标志:鉴定基础性生物过程。
- 观看科学网络研讨会,应激颗粒:破译与神经退变的联系。
选择参考文献:
- Wheeler JR, Matheny T, Jain S, Abrisch R, Parker R. Distinct stages in stress granule assembly and disassembly. Elife. 2016;5:e18413. Published 2016 Sep 7. doi:10.7554/eLife.18413. CC BY 4.0.
- Mahboubi H, Stochaj U. Cytoplasmic stress granules: Dynamic modulators of cell signaling and disease. Biochim Biophys Acta Mol Basis Dis. 2017;1863(4):884-895. doi:10.1016/j.bbadis.2016.12.022
- Panas MD, Ivanov P, Anderson P. Mechanistic insights into mammalian stress granule dynamics. J Cell Biol. 2016;215(3):313-323. doi:10.1083/jcb.201609081
- Marcelo A, Koppenol R, de Almeida LP, Matos CA, Nóbrega C. Stress granules, RNA-binding proteins and polyglutamine diseases: too much aggregation?. Cell Death Dis. 2021;12(6):592. Published 2021 Jun 8. doi:10.1038/s41419-021-03873-8
- Tourrière H, Chebli K, Zekri L, et al. The RasGAP-associated endoribonuclease G3BP assembles stress granules. J Cell Biol. 2003;160(6):823-831. doi:10.1083/jcb.200212128
- Reineke LC, Dougherty JD, Pierre P, Lloyd RE. Large G3BP-induced granules trigger eIF2α phosphorylation. Mol Biol Cell. 2012;23(18):3499-3510. doi:10.1091/mbc.E12-05-0385
- Ghisolfi L, Dutt S, McConkey ME, Ebert BL, Anderson P. Stress granules contribute to α-globin homeostasis in differentiating erythroid cells. Biochem Biophys Res Commun. 2012;420(4):768-774. doi:10.1016/j.bbrc.2012.03.070
- Matsuki H, Takahashi M, Higuchi M, Makokha GN, Oie M, Fujii M. Both G3BP1 and G3BP2 contribute to stress granule formation. Genes Cells. 2013;18(2):135-146. doi:10.1111/gtc.12023
- Kedersha N, Panas MD, Achorn CA, et al. G3BP-Caprin1-USP10 complexes mediate stress granule condensation and associate with 40S subunits [published correction appears in J Cell Biol. 2020 Jan 6;219(1):]. J Cell Biol. 2016;212(7):845-860. doi:10.1083/jcb.201508028
- Kedersha NL, Gupta M, Li W, Miller I, Anderson P. RNA-binding proteins TIA-1 and TIAR link the phosphorylation of eIF-2 alpha to the assembly of mammalian stress granules. J Cell Biol. 1999;147(7):1431-1442. doi:10.1083/jcb.147.7.1431
- Waris S, Wilce MC, Wilce JA. RNA recognition and stress granule formation by TIA proteins. Int J Mol Sci. 2014;15(12):23377-23388. Published 2014 Dec 16. doi:10.3390/ijms151223377
- Gilks N, Kedersha N, Ayodele M, et al. Stress granule assembly is mediated by prion-like aggregation of TIA-1. Mol Biol Cell. 2004;15(12):5383-5398. doi:10.1091/mbc.e04-08-0715
- Cirillo L, Cieren A, Barbieri S, et al. UBAP2L Forms Distinct Cores that Act in Nucleating Stress Granules Upstream of G3BP1. Curr Biol. 2020;30(4):698-707.e6. doi:10.1016/j.cub.2019.12.020
- Neumann M, Sampathu DM, Kwong LK, et al. Ubiquitinated TDP-43 in frontotemporal lobar degeneration and amyotrophic lateral sclerosis. Science. 2006;314(5796):130-133. doi:10.1126/science.1134108
- Winton MJ, Igaz LM, Wong MM, Kwong LK, Trojanowski JQ, Lee VM. Disturbance of nuclear and cytoplasmic TAR DNA-binding protein (TDP-43) induces disease-like redistribution, sequestration, and aggregate formation. J Biol Chem. 2008;283(19):13302-13309. doi:10.1074/jbc.M800342200
- Bentmann E, Neumann M, Tahirovic S, Rodde R, Dormann D, Haass C. Requirements for stress granule recruitment of fused in sarcoma (FUS) and TAR DNA-binding protein of 43 kDa (TDP-43). J Biol Chem. 2012;287(27):23079-23094. doi:10.1074/jbc.M111.328757
- Mann JR, Gleixner AM, Mauna JC, et al. RNA Binding Antagonizes Neurotoxic Phase Transitions of TDP-43. Neuron. 2019;102(2):321-338.e8. doi:10.1016/j.neuron.2019.01.048
- Vance C, Scotter EL, Nishimura AL, et al. ALS mutant FUS disrupts nuclear localization and sequesters wild-type FUS within cytoplasmic stress granules. Hum Mol Genet. 2013;22(13):2676-2688. doi:10.1093/hmg/ddt117
- Vanderweyde T, Apicco DJ, Youmans-Kidder K, et al. Interaction of tau with the RNA-Binding Protein TIA1 Regulates tau Pathophysiology and Toxicity. Cell Rep. 2016;15(7):1455-1466. doi:10.1016/j.celrep.2016.04.045
- Wolozin B, Ivanov P. Stress granules and neurodegeneration. Nat Rev Neurosci. 2019;20(11):649-666. doi:10.1038/s41583-019-0222-5







 沪公网安备31011502018823号
沪公网安备31011502018823号