Rajan Burt、Samuel Myers 以及来自拉荷亚免疫学研究所、博德研究所、Cell Signaling Technology 和耶鲁大学的同事结合他们的专业知识,成功开辟出一条识别遍在性蛋白质修饰 O-GlcNAc 糖基化的新途径。这些工作的结果发表在《分子与细胞蛋白质组学》杂志上的论文《Novel Antibodies for the Simple and Efficient Enrichment of Native O-GlcNAc Modified Peptides(简单高效富集天然 O-GlcNAc 修饰肽的新型抗体)》中。
特异性不再遥不可及之时
这是一个年代久远的故事,因为在几乎 40 年前的1984 年,Torres 和 Hart 鉴定了简单糖或单糖 O-GlcNAc。O-GlcNAc 是最常见的翻译后修饰 (PTM) 之一。这在细胞内部(包括细胞核、细胞质和线粒体)的蛋白质上随处可见。请不要与面向胞外环境的蛋白质上高度复杂的 N-连接糖类混淆,O-GlcNAc 是一种参与最精巧生物学通路的简单单糖,这些生物学通路涉及对转录、应激反应、翻译、蛋白降解和稳态的表观遗传调节。
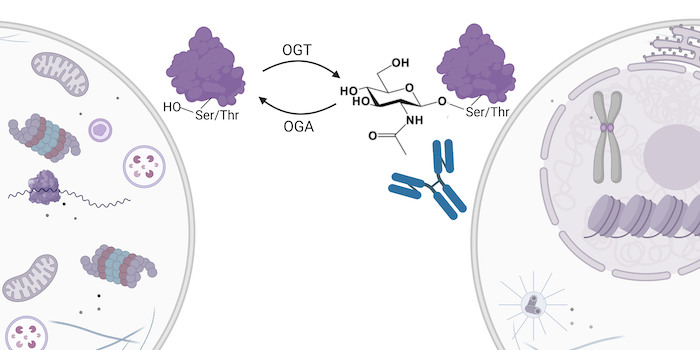
由于 O-GlcNAc 作为细胞营养水平感受器发挥作用,因此充当多条信号转导通路的整合器。值得注意地,O-GlcNAc 糖基化在细胞层面仅受两种蛋白质控制:将单糖添加到丝氨酸和苏氨酸残基上的 OGT 以及酶促反应去除 PTM 的 OGA。更新、更全面的信号转导模型不再仅仅是激活和抑制的线性模型,而是包含多种通路以及多种反馈和串扰模式的模型。这在一定程度上解释一种 PTM 如何参与人类中诸如糖尿病、神经退行性疾病和癌症等看似多样的疾病。
针对 O-GlcNAc 的灵敏、特异性单克隆抗体
了解 O-GlcNAc 在生物学和疾病中作用的关键之处在于可靠鉴定 PTM。Cell Signaling Technology 的科学家们已经研发出一种灵敏且特异的兔单克隆抗体混合物,它可以在一个步骤免疫沉淀源自亲本蛋白的 O-GlcNAc 糖基化肽。这种基于抗体的新工具结合博德研究所科学家开发的质谱分析法取得进展,允许在一个富集步骤鉴定一千多个独特的 O-GlcNAc 糖基化位点。
![PTMScan® O-GlcNAc [GlcNAc-S/T] Motif Kit](https://media.cellsignal.com/product/image/95220_fig02___20210423082456.png) 使用通过 PTMScan® O-GlcNAc [GlcNAc-S/T] Motif Kit 富集和鉴定的胰蛋白酶肽进行基序分析。将 10 μM Thiamet-G (TMG) 处理 6 小时的 HeLa 细胞用胰蛋白酶消化,并用 PTMScan® O-GlcNAc [GlcNAc-S/T] Immunoaffinity Beads 免疫沉淀。Orbitrap Fusion Lumos 质谱仪分析法鉴定了共 1,235 个非冗余位点。
使用通过 PTMScan® O-GlcNAc [GlcNAc-S/T] Motif Kit 富集和鉴定的胰蛋白酶肽进行基序分析。将 10 μM Thiamet-G (TMG) 处理 6 小时的 HeLa 细胞用胰蛋白酶消化,并用 PTMScan® O-GlcNAc [GlcNAc-S/T] Immunoaffinity Beads 免疫沉淀。Orbitrap Fusion Lumos 质谱仪分析法鉴定了共 1,235 个非冗余位点。
此外,与其差向异构体 O-GalNAc 相比,对 O-GlcNAc 的强烈偏好证明了 O-GlcNAc 抗体的灵敏度和特异性。该技术可能轻易应用于天然 O-GlcNAc 修饰的肽,使研究者在体内探索 O-GlcNAc 问题。
因此,不用复杂且耗时的化学衍生、使用比先前实验少 10 倍的样品及投入明显更少的质谱仪时间,本研究演示了高特异性试剂和创新质性谱分析法在创建发现途径方面的协同作用。
21-ETC-55250






 沪公网安备31011502018823号
沪公网安备31011502018823号