您知道六月是癌症免疫疗法研究宣传月吗?今年,我们将庆祝《科学》杂志 2013 年公认癌症免疫疗法为“年度科学突破”十周年。30 多种癌症可用免疫疗法治疗,宣传月的目标是进一步增加这个数字及给甚至更癌症患者送去挽救生命的疗法。
免疫疗法如何瞄准癌症?
侧重于消除癌细胞的传统癌症治疗,例如放射疗法和化学疗法,可能具有致弱性身体和精神副作用并且往往对转移性癌症成功有限。这类治疗往往也不产生长期治愈,因为患者可能实现缓解或出现治疗耐药性。
免疫疗法让患者自身免疫系统准备好识别并攻击癌细胞,为消除癌症提供一种替代性方法。对于使用传统方法时具有不良临床转归的癌症,例如转移性黑色素瘤或胰腺导管腺癌,使用一种不同范式提高其生存率。免疫疗法还有可能实现长期缓解的附加益处,因为免疫系统可以识别复现的癌细胞,从而产生持久—可能永久—性癌防护。
免疫疗法在拜登政府的抗癌登月 (Cancer Moonshot) 计划中发挥着重要作用,该计划的目标是“截至未来 25 年降低癌症死亡率达 50% 并改善携癌共生者和癌幸存者的体验。”作为该计划的一部分,美国国会已投资 18 亿美元资助研究,包括免疫疗法以及患者外展服务工具。在癌症研究所 (CRI, Cancer Research Institute),已在免疫疗法研究方面投资 4 亿美元,与此同时,美国国家癌症研究所 (NCI, National Cancer Institute) 继续通过从基础科学研究到临床研究应用连续资助,支持免疫疗法。
如今存在多少类型的免疫疗法?
目前,存在多个免疫疗法类型:
- 检查点抑制剂:阻断癌症用来逃避免疫系统的免疫检查点。
- 免疫调节剂: 刺激人体的免疫应答,有效对抗癌症。用于治疗癌症的免疫调节剂包括细胞因子、激动剂和佐剂。
- 过继性细胞疗法: 从患者分离免疫细胞,以扩充特定细胞群体或修饰这些群体旨在识别癌抗原。过继性细胞疗法包括 CAR-T 疗法、肿瘤浸润性淋巴细胞 (TIL) 疗法、工程化 T 细胞受体疗法和自然杀伤 (NK) 细胞疗法。
- 靶向抗体: 使用针对癌特异性抗原的单克隆抗体。抗体可以为单特异性、双特异性或与细胞毒性药物偶联。
- 溶瘤性病毒疗法: 修饰某病毒以特异性感染并杀伤癌细胞,而不影响非癌细胞。美国食品药物监督管理局 (FDA) 已批准 IMLYGIC,这是一种直接注入肿瘤时杀伤转移性黑色素瘤细胞的改良疱疹病毒。
- 癌症疫苗: 训练免疫系统识别已建立的癌或预防由病毒引起的癌发生。FDA 已批准预防宫颈癌和肝癌的疫苗以及治疗前列腺癌、转移性黑色素瘤和早期膀胱癌的疫苗。
随着我们更多了解 T 细胞以及其他免疫细胞类型如何行事及如何与癌症细胞相互作用,免疫疗法类型和特效治疗药的清单持续变长。
癌症免疫疗法研究的热点是什么?
检查点抑制剂
近来,检查点抑制剂颇受关注,James Allison 博士和 Tasuku Honjo 博士因其发现癌细胞如何利用 CTLA-4 和 PD-1 逃避免疫系统荣获 2018 年诺贝尔奖。不过,这两种分子的作用机制并不相同。CTLA-4 是一种通常用于借助与共刺激分子 CD28 竞争结合配体来限制 T 细胞激发,从而保持免疫应答受控的免疫抑制分子。伊匹木单抗是 FDA 在 2011 年批准的第一种检查点抑制剂,抑制 CTLA-4,从而允许 T 细胞应答于肿瘤抗原。
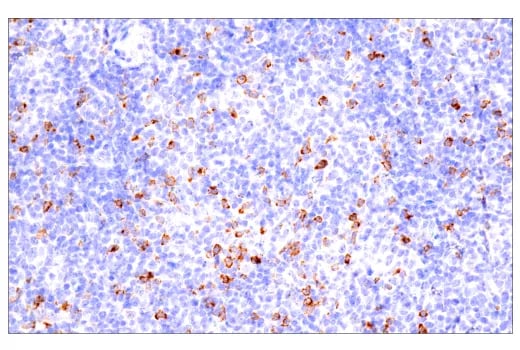
使用 CTLA-4 (E2V1Z) Rabbit mAb #53560 在 Leica Biosystems 的 BOND RX 全自动研究染色机上对石蜡包埋的人 B 细胞非霍奇金淋巴瘤进行免疫组织化学分析。
另一方面,PD-1 由激发的 T 细胞表达并且与肿瘤微环境 (TME) 内肿瘤细胞和骨髓细胞上表达的 PD-L1 相互作用时,抑制 T 细胞活性。派姆单抗 和 纳武单抗 均阻断 PD-1 与 TME 和肿瘤本身表达的 PD-L1 相互作用,从而恢复已耗尽 T 细胞的功能。
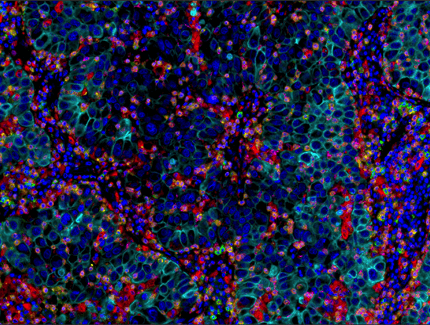 使用 PD-1 (EH33) Mouse mAb #43248(绿色)、CD8α (C8/144B) mouse mAb #70306(品红色)、CD68 (D4B9C) XP® rabbit mAb #76437(红色)、Pan-keratin (C11) mouse mAb #4545(青色)、LAG3 (D2G4O™) XP® rabbit mAb #15372(橙色)和 TIM-3 (D5D5R™) XP® rabbit mAb #45208(黄色)对石蜡包埋的人肺腺癌组织进行多重免疫组织化学分析。
使用 PD-1 (EH33) Mouse mAb #43248(绿色)、CD8α (C8/144B) mouse mAb #70306(品红色)、CD68 (D4B9C) XP® rabbit mAb #76437(红色)、Pan-keratin (C11) mouse mAb #4545(青色)、LAG3 (D2G4O™) XP® rabbit mAb #15372(橙色)和 TIM-3 (D5D5R™) XP® rabbit mAb #45208(黄色)对石蜡包埋的人肺腺癌组织进行多重免疫组织化学分析。
- 然而,检查点抑制剂仅成功地治疗有限的癌症患者群体。因此,人们正努力评估一种检查点抑制剂联用另一种检查点抑制剂或另一种疗法的疗效和安全性。例如,PD-1 抑制剂纳武单抗和 CTLA-4 抑制剂伊匹木单抗的组合经批准用于治疗转移性非小细胞肺癌(NSCLC)。此外,抑制另一个免疫检查点 LAG3 的瑞拉利单抗最近由 FDA 批准用于联合 PD-1 抑制剂纳武单抗治疗不可切除或转移性黑色素瘤。
靶向抗体免疫疗法
靶向抗体可用于阻断靶向的分子功能、诱导细胞凋亡或调节信号转导通路。例如,当单克隆抗体赫赛汀与乳腺癌和胃癌中过表达的 HER2 受体结合时,它减弱下游信号通路以诱导细胞凋亡并停滞细胞增殖。大约 25% 的乳腺癌呈 HER2 阳性,这使其成为当前癌症疗法武器库中强大的“银弹”。2 赫赛汀自 1998 年以来已获得批准,但研究人员仍在寻求通过研究不同表位或修饰抗体以提高结合作用而增加疗效或降低细胞毒性的方式。该抗体还可以与化疗酬载偶联(抗体-药物缀合物),以特异性导引细胞毒性分子至肿瘤。最后,双特异性抗体是一种新方法,它将源自两种不同抗体的可变区组合成单个分子,从而该分子可以识别来自例如癌细胞和 T 细胞的表位。双特异性抗体使 T 细胞近邻于肿瘤,导致 T 细胞活化、增殖及 T 细胞介导的癌细胞杀伤。第一种双特异性抗体 博纳吐单抗 于 2014 年经 FDA 批准用于治疗白血病患者。
大多数靶向抗体疗法利用免疫球蛋白 G (IgG) 和 T 细胞刺激免疫系统。但是,正在进行探究其他免疫细胞和免疫球蛋白类型以扩展免疫疗法范围的研究。例如,使用免疫球蛋白 E (IgE) 靶向硫酸软骨素蛋白多糖 4 (CSPG4)(高达 70% 的黑色素瘤上存在)的研究在小鼠中显示前景光明的结果。3通常在遇到花粉等过敏原时,作出 IgE 抗体响应。与基于 IgG 的治疗药相比,基于于 IgE 的治疗药的一些(但不是全部)潜在优势包括对 FceRI 受体的亲和力更高、缺乏 IgE 的抑制性受体、相比 IgG 能够引发具有不同效应细胞的反应、血液中内源水平较低并因此受体结合竞争较小,并且其能够介导抗体依赖性细胞介导的细胞毒性 (ADCC),而无需补体介导的细胞毒性 (CDC)。4
过继性细胞治疗
过继性细胞疗法是一种个体化医疗形式,它在体外扩充或修饰来自患者或捐赠者的免疫细胞,从而免疫细胞能够识别并杀上肿瘤细胞。 然后将修饰后的细胞再输注入患者中。过继性细胞疗法通常称为“活体药物”,包括肿瘤浸润性淋巴细胞 (TIL) 和嵌合抗原受体 (CAR) T 细胞疗法。5
TIL 是识别并且已穿透肿瘤、但受来自肿瘤和 TME 的信号免疫抑制的血细胞。将一组识别多种癌症抗原的 TIL从肿瘤活检样品分离并扩充,然后输注入患者以寻找并摧毁肿瘤。TIL 联用白细胞介素 2 (IL-2) 和化疗治疗黑色素瘤和其他实体瘤的疗效和安全性非常有前景。5 然而,长出数目为成功治疗所需的 TIL 可能耗时数月,一个并非所有患者都具备的时间,并且一些分离的 TIL 难以生长或未表现出强烈的效应子应答。目前正在研究使用 TIL 与检查点抑制剂的联合疗法。FDA 还批准了工程化 TIL 的 IND 许可,其中 TIL 已修改成无 IL-2 情况下有效,以增加可能从这种有前景方法中受益的患者人数。
CAR-T 疗法是目前最受追捧的过继细胞疗法类型,原因是治疗侵袭性白血病和淋巴瘤时证明了其缓解率和持久缓解的频率高。CAR-T 细胞是这样的免疫细胞,它们从患者身上采集并且经工程化以表达识别肿瘤抗原并诱导肿瘤细胞死亡的表面受体。FDA 已批准以儿童急性淋巴细胞白血病和成人 B 细胞淋巴瘤、滤泡性淋巴瘤、套细胞淋巴瘤和多发性骨髓瘤为目标的六种 CAR-T 疗法。然而,由于包括鉴定肿瘤特异性抗原、TME 的免疫抑制性质以及 CAR-T 相关毒性的难题,因此尚未满足对用于实体瘤的成功 CAR-T 疗法的需求。6 正在付出巨大精力寻找减轻 TME 作用的方法,例如用 CAR-T 细胞联合检查点抑制剂药物治疗患者,或者工程化特异性抵抗 TME 中免疫抑制信号的 CAR。
对广泛使用 CAR-T 疗法的另一个限制是分离 T 细胞、使之工程化以表达 CAR 以及验证 CAR 表面表达所花费的时间。遗憾的是,如果难以找到具有所需特异性的检测试剂,那么监测 CAR 表面表达可能复杂。避免这个问题的一种方法是使用抗 CAR 接头抗体以抗原非依赖方式验证 CAR-T,这类抗体识别 scFv 上可变重链结构域和可变轻链结构域之间的接头序列。
癌症疫苗
开发 COVID-19 疫苗所要求的紧迫性带来了突破,随着我们更好了解免疫系统,这些突破现在正应用于癌症疫苗。7 促进针对去势抵抗性前列腺癌和高风险肌层浸润性膀胱癌 (NMIBC) 的免疫应答的治疗性疫苗最初是一种有前景的治疗方法,但在 21世纪十年间几乎被放弃,现已获得 FDA 批准。7 核酸疫苗技术的出现解决了诸如生产时间和在免疫受损患者中使用减毒活疫苗之间的冲突等难题。预防性疫苗也已开发,防范宫颈癌的抗人乳头瘤病毒 (HPV) 疫苗和可以防范防肝癌的乙型肝炎病毒疫苗最引人注目。针对非病毒性癌的预防性疫苗尚未进入临床。然而,研究人员正在研究改进的诊断和筛查工具是否可以联用治疗性疫苗,以在癌症进展到晚期之前促进抗癌免疫力。
肿瘤研究前景广阔
虽然免疫疗法为患者提供了更多的治疗选项,但它绝不是针对癌症的灵丹妙药、一劳永逸之法。使用诸如手术、化疗和放疗等传统疗法联合上述免疫疗法选项,将赋予临床医生为每位患者制定有效治疗策略的能力。
也在继续探索诸多项新颖且令人兴奋的突破。例如,最近研究表明,微调肠道微生物组可以改善患者对治疗做出反应的能力。研究人员用源于癌症患者的微生物群接种小鼠的结肠时,发现与治疗反应性相关的PD-L2 和 RGMb 蛋白表达有变化。8 此外,用杀死肠道细菌的广谱抗生素治疗小鼠降低了小鼠对抗 PD-1 免疫疗法做出反应的能力。这表明患者肠道的定殖接种可以增加对免疫疗法做出反应的患者数目。
免疫疗法已经改变肿瘤治疗格局,赋予临床医生更多治疗选项从中选择。随着我们更多了解免疫系统并思索利用调节机制的创新性策略,选项数目将只会增长—我们来到可以预防癌症及治愈转移性癌症的那一天也更近了。
想要了解更多?查看这些 CST 工具和参考资料
参考文献
- Puhr HC, Ilhan-Mutlu A. New emerging targets in cancer immunotherapy: the role of LAG3. ESMO Open. 2019;4(2):e000482. 2019 年 3 月 12 日发表. doi: 10.1136/esmoopen-2018-000482.
- Costa RLB, Czerniecki BJ. Clinical development of immunotherapies for HER2+ breast cancer: a review of HER2-directed monoclonal antibodies and beyond. NPJ Breast Cancer. 2020;6:10. 2020 年 3 月 12 日发表. doi:10.1038/s41523-020-0153-3
- Chauhan J 等人. Anti-cancer pro-inflammatory effects of an IgE antibody targeting the melanoma-associated antigen chondroitin sulfate proteoglycan 4. Nat Commun. 2023;14(1):2192. 2023 年 4 月 25 日发表. doi: 10.1038/s41467-023-37811-3.
- Leoh LS, Daniels-Wells TR, Penichet ML. IgE immunotherapy against cancer. Curr Top Microbiol Immunol. 2015;388:109-49.
- Kirtane K, Elmariah H, Chung CH, Abate-Daga D. Adoptive cellular therapy in solid tumor malignancies: review of the literature and challenges ahead. J Immunother Cancer. 2021;9(7):e002723. doi:10.1136/jitc-2021-002723.
- Sterner RC, Sterner RM. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer J. 2021;11(4):69. 2021 年 4 月 6 日发表. doi:10.1038/s41408-021-00459-7.
- Grimmett E, Al-Share B, Alkassab MB, Zhou RW, Desai A, Rahim MMA, Woldie I. Cancer vaccines: past, present and future; a review article. Discov Oncol. 2022;13(1):31. 2022 年 5 月 16 日发表. doi:10.1007/s12672-022-00491-4
- Park JS, Gazzaniga FS, Wu M 等人 Targeting PD-L2-RGMb overcomes microbiome-related immunotherapy resistance [已发表内容的纠正出现于 Nature. 2023 年 6 月 1 日;:]. Nature. 2023;617(7960):377-385. doi:10.1038/s41586-023-06026-3
Cell Signaling Technology 多重测定法开发部门副总监 Sarah Klein 博士对撰写和审阅本文做出贡献。
23-CAN-85660





 沪公网安备31011502018823号
沪公网安备31011502018823号