在坏死性细胞死亡的类别中,有许多特征鲜明的细胞破坏过程,以及一些新近描述的细胞破坏过程。与经典思维相反,坏死性细胞死亡在自然界中并不总是物理的和偶然的。相反,当细胞处于压力下并且其他细胞死亡方法不可行时,它们可能会触发特定的程序性自毁通路。
靶向经典和非经典细胞焦亡通路中的关键蛋白质的抗体是研究这种独特细胞死亡形式的研究人员的重要工具。
细胞焦亡的机制和通路
焦亡是一种程序性坏死细胞死亡,在存在病原体相关的分子模式 (PAMP) 或细胞衍生的损伤相关的分子模式 (DAMP) 的情况下,细菌、病毒、真菌和原生动物的细胞内感染会激活焦亡。它通常在先天免疫系统的细胞(例如单核细胞、巨噬细胞和树突状细胞)中被诱导。
探索交互式坏死性细胞死亡通路图
焦亡通常是病原体感染后可能触发的主要细胞死亡方式,人们认为当 caspase 酶无法获得时,其他类型的细胞死亡(如坏死性凋亡)会作为继发过程发生。发生焦亡的细胞显示出诸如细胞肿胀、膜起泡、DNA 断裂和最终细胞裂解等特征。但是,细胞核通常保持完整,这与凋亡和坏死性凋亡中观察到的细胞核破坏现象不同。
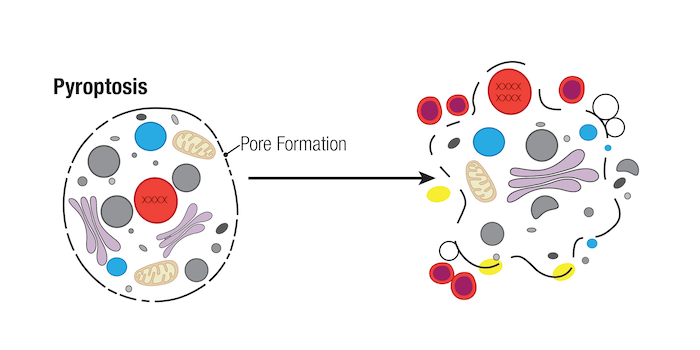
由于 DNA 片段化过程为随机并且胞核保持完整,因此用 TUNEL 测定法分析时,焦亡性细胞会生成的阳性信号低。然而,需要其他测定法区分细胞焦亡、其他类型的坏死和凋亡。
针对如下所述标记物的特异性抗体可用于识别细胞焦亡并区分其不同途径。
用于研究细胞焦亡的抗体靶标
焦亡的特征是胃泌素 D(GSDMD)的氨基末端裂解,导致寡聚化,从而在质膜上形成裂解孔。这种剪切过程依赖于炎症因子 caspase-1、caspase-4、caspase-5 和/或 caspase-11 的活性,这些与凋亡过程中活跃的 caspase 酶不同。因此,监测 GSDMD 及其相关家族成员以及这些炎症 caspase 的裂解是研究细胞焦亡的关键标记物。然而,值得注意的是,不同的 caspase 参与不同的细胞焦亡通路,如下所述。
炎症性 caspase 在先天性免疫系统中发挥重要作用,并且能够使免疫细胞对细菌感染产生反应,因为它们参与了促炎性细胞因子的处理和分泌,例如促白细胞介素-1β(促 IL-1β)和促白细胞介素-18(促 IL-18)。
存在两种不同的细胞焦亡通路,即经典通路和非经典通路,可以使用不同的标记物进一步区分。
经典凋亡通路
焦亡经典通路通常被描述为通过两步过程发生。在第一个“启动信号”步骤中,激活核因子 κB (NF-kB) 以诱导多种蛋白质的表达,这些蛋白质将成为所谓的炎性小体的复合体的一部分。炎症小体通常由胞质模式识别受体(即 PRR,例如 NLRP3 或 AIM2 样家族成员)、接头蛋白 (ASC/TMS1) 和促 caspase-1 组成。通过检测 NLRP3 和可视化 ASC 斑点来分析炎性小体的激活是监测焦亡的另一种有用技术。
在第二个激活步骤中,caspase-1 在裂解 gasdermin D 和细胞因子(促 IL-1β 和促 IL-18)前被蛋白水解激活,从而产生其促炎症形式 IL1β 和 IL18,这些是由死亡细胞分泌的。重要的是,caspase-1 还可切割关键蛋白 gasdermin D(GSDMD)的氨基末端片段,使其寡聚并在细胞膜上形成孔。这会导致细胞因子分泌、进水和最终的细胞破裂。
Caspase-1、NLRP3 和 ASC 斑点都是经典焦亡通路的重要标记物。
非经典焦亡通路
另外,可以通过细胞内检测革兰氏阴性细菌 LPS 的非经典通路来诱导焦亡,从而激活 caspase-4、caspase-5 和/或 caspase-11(小鼠 caspase-11)以剪切 GSDMD。因此,激活这些 caspase 有助于识别非经典焦亡通路。
由于 GSDMD 在经典和非经典通路中均被剪切,因此监测 GSDMD 的剪切和易位是识别通过任一通路发生的细胞焦亡的重要部分。
疾病研究中的焦亡
研究焦亡的机制可能会为癌症、自身免疫性疾病、神经退行性疾病等带来治疗益处。有研究证明 ω-3 脂肪酸在三阴性乳腺癌细胞中能激活焦亡,表明焦亡具有介导癌症的潜力;然而其机制仍有待阐明。在炎性肠病中,炎症小体激活和 caspase 诱导表明存在焦亡,这可能也是开发新型治疗药物的有前景的研究方向。
其他资源
要更多了解参与多种类型细胞死亡的机制、形态和关键蛋白质,请下载下面的指南:
阅读细胞死亡机制系列中的其他博客文章:
探索我们的 CST® TUNEL 试剂盒,该试剂盒可有效检测正在经历凋亡和其他形式的程序性细胞死亡的细胞,以及我们的细胞焦亡抗体小包装组合:
参考文献
- Galluzzi L, Vitale I, Aaronson SA, et al. Molecular mechanisms of cell death: recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death Differ. 2018;25(3):486-541. doi:10.1038/s41418-017-0012-4
- Frank D, Vince JE. Pyroptosis versus necroptosis: similarities, differences, and crosstalk. Cell Death Differ. 2019;26(1):99-114. doi:10.1038/s41418-018-0212-61.
- Escobar ML, Echeverría OM, Vázquez-Nin GH. Necrosis as Programmed Cell Death. In: Cell Death - Autophagy, Apoptosis and Necrosis. InTech.







 沪公网安备31011502018823号
沪公网安备31011502018823号