自 2000 年以来,Cell Signaling Technology (CST) 为蛋白质印迹法应用(WB) 提供了一种经严格测试且广泛引用的多克隆抗体产品 Nitro-Tyrosine Antibody #9691,它识别硝基-酪氨酸蛋白。鉴于人们更广泛争论多克隆抗体是否适合研究1,2以更好理解受硝基-酪氨酸特异性调节的细胞通路,CST 已为 WB 和蛋白质组学应用开发了两种针对相同翻译后修饰(PTM) 的重组单克隆抗体产品:
- 蛋白质印迹法 (WB):Nitro-Tyrosine (D2W9T) Rabbit mAb #92212
- 蛋白质组学:PTMScan® Nitro-Tyrosine Motif [Nitro-Y] Kit #44462
这些新试剂连同既存多克隆产品的可获性为用户提供更大信心和更多机会在其生物系统中探索硝基-酪氨酸。
有现代关联性的长期目标
不要与据宣称将轿车加速到接近光速的一氧化二氮系统 (NOS) 混淆,酪氨酸亚硝化作用 (NOS) 在实验室和生物学中发挥关键作用。已经长久使用酪氨酸体外亚硝化以产生硝基-酪氨酸(也称为 3-硝基酪氨酸)作一项探测蛋白质结构和相互作用的技术。3,4
作为创新者,大自然也找到了调节硝基-酪氨酸的方式。骨髓源性抑制细胞 (MDSC) 释放使细胞毒性 T 淋巴细胞上蛋白质亚硝基化的活性氮种类 (RNS)。一但硝基-酪氨酸形成,T 细胞活性就衰减;因此这种 PTM 为细胞提供一种逃避免疫治疗的机制。5
另外,可以用尿酸清除生成硝基-酪氨酸的相同 RNS。在血脑屏障受损相关疾病(如多发性硬化症)的动物模型中,施用尿酸局部地恢复血脑屏障完整性,这假定通过拮抗硝基-酪氨酸形成做到。6
不提及以下另一种酪氨酸 PTM,那么,对硝基-酪氨酸的介绍就不完整:磷酰-酪氨酸(图 1B)。在蛋白酪氨酸激酶 Src 家族 (SFK) (包括 Lyn 酪氨酸激酶)中,Src 同源性 2 (SH2) 结构域负向自动调节该酶。在 SH2 结构域中指定位点上形成磷酰-酪氨酸或硝基-酪氨酸防止抑制作用,从而激活激酶活性。7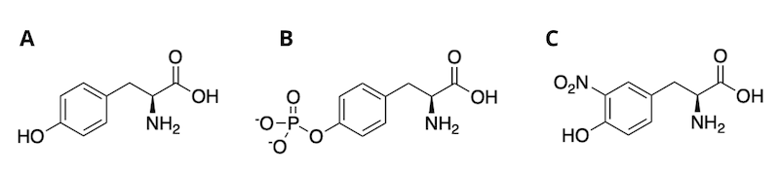 图 1. 未修饰的酪氨酸 (A)、磷酰-酪氨酸 (B) 和硝基-酪氨酸 (C) 的结构。
图 1. 未修饰的酪氨酸 (A)、磷酰-酪氨酸 (B) 和硝基-酪氨酸 (C) 的结构。
使用特异性试剂分析硝基-酪氨酸或磷酰-酪氨酸(这可以使用 Phospho-Tyrosine (P-Tyr-1000) MultiMab™ Rabbit mAb mix #8954 实现),可以阐明这两种天然存在性 PTM 的作用。
一种新的单克隆蛋白质印迹产品
对于对许多含有特定 PTM 的底物具有广泛反应性的泛 PTM 抗体,多克隆抗体有时优于单克隆抗体,因为它们能够检测多种抗原。然而,我们在 CST 用来开发我公司创新性 PTMScan® 系列产品的抗原设计和抗体筛选流程能够发现展示这种独特功能(即能够识别许多含有特定 PTM 的底物)的单克隆抗体。这使得研究人员受益于使用单克隆抗体的优势(即抗体结合一致性),同时仍然探索单一、特异性 PTM。
对于硝基-酪氨酸,CST 开发了单克隆抗体 Nitro-Tyrosine (D2W9T) Rabbit mAb #92212,该抗体在 WB 应用中识别用 RNS 试剂过氧亚硝酸盐处理的细胞的许多修饰型蛋白质。通过两种方式评估PTM 特异性:
- 首先,将一抗与硝基-酪氨酸肽预孵育(图 2),以及
- 其次,使用连二亚硫酸钠,将硝基-酪氨酸修饰过程的化学还原用于抗体不识别的抗原(图 3)。8
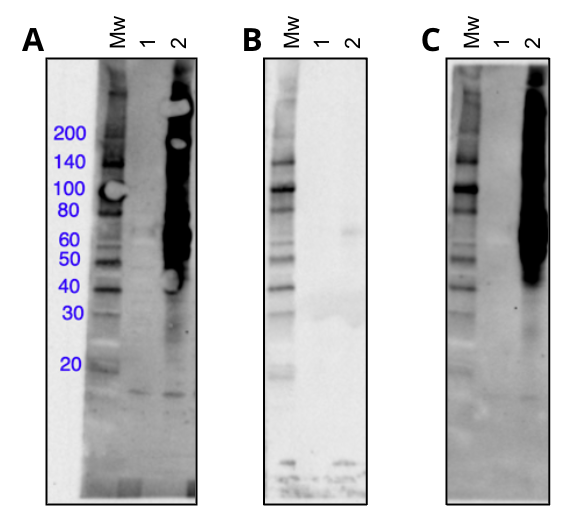
图 2. 使用单克隆抗体 Nitro-Tyrosine (D2W9T) Rabbit mAb #92212 对未经处理(泳道 1)或经氧亚硝酸盐处理(泳道 2)的 Hela 细胞进行蛋白质印迹分析,该 Hela 细胞未用任何物质封闭 (A)、经简并性硝基-酪氨酸肽文库封闭 (B) 或经简并性磷酰-酪氨酸肽文库封闭 (C)。
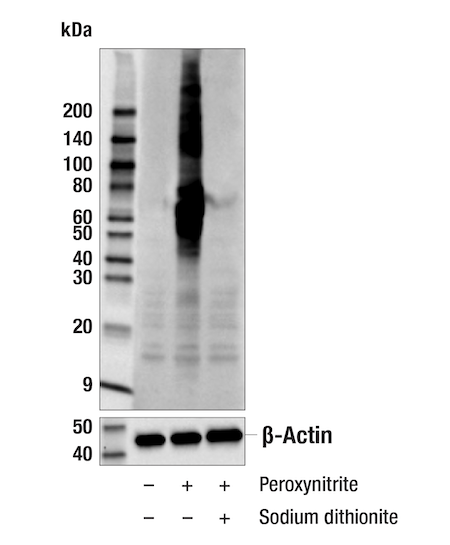
图 3. 使用单克隆抗体 Nitro-Tyrosine (D2W9T) Rabbit mAb #92212 对未经处理(泳道 1)或经过氧亚硝酸盐处理(泳道 2)或经二亚硫酸钠处理(泳道 3)的 Hela 细胞提取物进行蛋白质印迹分析。
除了对硝基-酪氨酸具有特异性外,单克隆抗体还有额外益处:序列确定,从而便利生产期间的可追溯性。
使用蛋白质组学分析硝基-酪氨酸:新型 PTMScan 产品
尽管 WB 试剂提供了一种评估硝基-酪氨酸水平的便捷方法,但难以明确鉴定硝基-酪氨酸蛋白或区分这些蛋白质上各个修饰的位点。为了鉴定蛋白质和特定的硝基-酪氨酸位点,富集硝基-酪氨酸至关重要。在 20 世纪 70 年代首次证实使用硝基-酪氨酸特异性抗体富集含 PTM 的肽的构想,当时使用带有固定化多克隆抗体的柱从体外亚硝基化的蛋白质中富集胰蛋白酶肽。9
这种构想的一个较新迭代是 PTMScan 技术,这是 CST 开发的一种工作流程,为便利使用,其使用 PTM 特异性抗体在珠混悬液(而不是柱形式)中富集修饰的肽。使用液相色谱-质谱 (LCMS) 分析 PTMScan 富集的肽。
CST 已发布用于富集硝基-酪氨酸肽的 PTMScan 抗体珠产品,即 PTMScan® Nitro-Tyrosine Motif [Nitro-Y] Kit #44462。尽管相比 WB 测定法,PTMScan 测定法需要更多样品材料(毫克量级,而非微克量级),但能够明确鉴定并量化硝基-酪氨酸修饰的位点可能是无价之宝。此外,硝基-酪氨酸富集后留下的剩余肽样品(通流)可以用作后续 PTMScan 测定法的输入,以监测给定研究中其他的目的 PTM。CST 和杜克大学医学院之间的合作研究项目展示了此类依次 PTMScan 实验的示例。
从源自 HCT116 细胞的 10 毫克输入肽材料开始,可以用 PTMScan Nitro-Tyrosine Immunoaffinity Beads 鉴定到成百个独特的硝基-酪氨酸位点(图 4)。已鉴定位点的序列基序分析表明,该抗体对侧翼氨基酸几乎没有偏向。因此,PTMScan Nitro-Tyrosine Immunoaffinity Beads 是分析来自各种物种(即小鼠、人类)的硝基-酪氨酸位点的适合试剂。
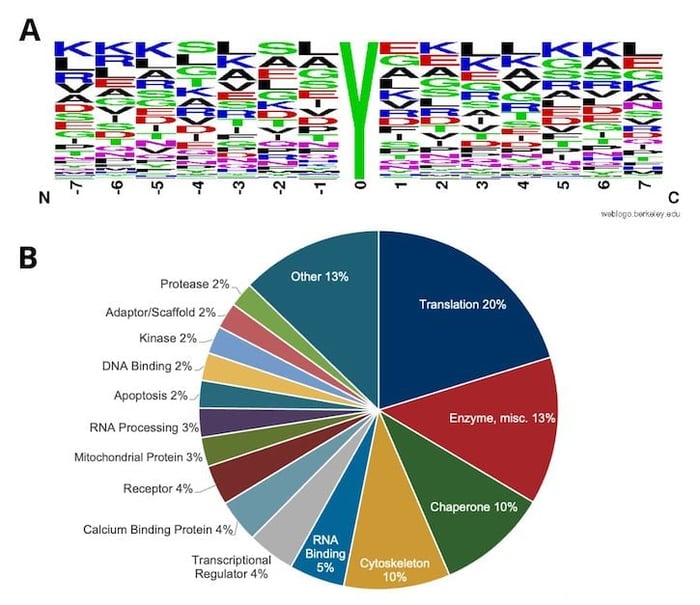 图 4. 使用通过 PTMScan Nitro-Tyrosine Motif [Nitro-Y] Kit #44462 从 HCT 116 人结肠癌细胞 (A) 富集和鉴定的涵盖 700 多个独特位点的所有硝基-酪氨酸肽进行基序分析,同时显示具有硝基-酪氨酸位点的蛋白质的相对类别分布 (B)。
图 4. 使用通过 PTMScan Nitro-Tyrosine Motif [Nitro-Y] Kit #44462 从 HCT 116 人结肠癌细胞 (A) 富集和鉴定的涵盖 700 多个独特位点的所有硝基-酪氨酸肽进行基序分析,同时显示具有硝基-酪氨酸位点的蛋白质的相对类别分布 (B)。
老目标,新工具
在癌症、神经退行性疾病和可能涉及氧化应激的其他疾病中,研究人员持续表征受硝基-酪氨酸影响的通路。借助对 WB 和蛋白质组实验做过验证的新型单克隆试剂,用户可以采用更全面的策略形成并检验关于这种 PTM 功能的假设。
相关 CST 产品
参考文献
- Ascoli CA, Aggeler B. Overlooked benefits of using polyclonal antibodies. Biotechniques. 2018;65(3):127-136. doi:10.2144/btn-2018-0065
- Bradbury A, Plückthun A. Reproducibility: Standardize antibodies used in research. Nature. 2015;518(7537):27-29. doi:10.1038/518027a
- Furth AJ, Hope DB. Studies on the chemical modification of the tyrosine residue in bovine neurophysin-II. Biochem J. 1970;116(4):545-553. doi:10.1042/bj1160545
- Irie M, Suito F. Studies on the state of tyrosyl residues in a ribonuclease from seminal vesicles. J Biochem. 1975;77(5):1075-1084. doi:10.1093/oxfordjournals.jbchem.a130808
- Feng S, Cheng X, Zhang L 等人, Myeloid-derived suppressor cells inhibit T cell activation through nitrating LCK in mouse cancers. Proc Natl Acad Sci U S A. 2018;115(40):10094-10099. doi:10.1073/pnas.1800695115
- Kean RB, Spitsin SV, Mikheeva T, Scott GS, Hooper DC. The peroxynitrite scavenger uric acid prevents inflammatory cell invasion into the central nervous system in experimental allergic encephalomyelitis through maintenance of blood-central nervous system barrier integrity. J Immunol. 2000;165(11):6511-6518. doi:10.4049/jimmunol.165.11.6511
- Mallozzi C, Di Stasi AM, Minetti M. Nitrotyrosine mimics phosphotyrosine binding to the SH2 domain of the src family tyrosine kinase lyn. FEBS Lett. 2001;503(2-3):189-195. doi:10.1016/s0014-5793(01)02726-0
- Sangsuwan R, Obermeyer AC, Tachachartvanich P, Palaniappan KK, Francis MB. Direct detection of nitrotyrosine-containing proteins using an aniline-based oxidative coupling strategy. Chem Commun (Camb). 2016;52(65):10036-10039. doi:10.1039/c6cc04575h
- Helman M, Givol D. Isolation of nitrotyrosine-containing peptides by using an insoluble-antibody column. Biochem J. 1971;125(4):971-974. doi:10.1042/bj1250971


 沪公网安备31011502018823号
沪公网安备31011502018823号