在过去三年里,COVID-19 疫情导致会议取消或改为虚拟形式,而在今年 11 月,来自世界各地的近 25,000 名神经科学家再次聚集在圣地亚哥,参加 2022 年神经科学学会 (SfN) 会议。在为期五天的年会期间,与会者分享了他们在推动该领域发展方面的最新发现、使用的新工具和采用的新技术。
作为神经科学家,我们认识到建立联系的重要性,以及在远程虚拟世界中建立强大网络的挑战性。鉴于空间生物学和计算基因组学一直处于神经科学研究的前沿,而且也是此次会议中主要探讨的话题,因而这一回归现场的活动恰如其分地提醒大家关注,接近度在建立联系和构建网络过程中的重要性。

Cell Signaling Technology 在 SfN 2022 上的展位。
毋庸置疑,再次见到大脑研究方面的科学家同行站在讲台上而不是通过计算机屏幕分享最近取得的突破性进展,而且还能与研究人员建立更深入、更有意义的持久联系,这种体验实在令人耳目一新。
SfN 2022 年回顾:2022 年阿尔茨海默病疗法喜忧参半
Biogen 和 Eisai 宣布他们为 Clarity 阿尔茨海默病 (AD) 确认性 3 期 Lecanemab 临床试验取得了积极的一线结果,这次会议恰逢其时。这一颇有前景的抗体药物似乎可以清除淀粉样斑块,并减缓 AD 患者的认知能力下降,虽然在展会上得到了一定程度的认可,但与会者仍对其持谨慎态度。神经科学家收到了关于 aducanumab 前景光明的类似消息,该消息以更大的声势发布出来,但因受到巨大争议而最终被迫放弃。
尽管我对这一潜在治疗突破的消息保持谨慎乐观的态度,但我仍心存疑虑,我认为只有对 AD 的细胞和分子基础有更加充分的了解,届时才会取得真正的进展。当然,新工具、新技术和更相关的模型系统将会加速这一领域的发现。最重要的是,了解大脑中的所有细胞如何相互连接和连接成网络,这一点仍然是推动 AD 研究发现的关键所在。
神经退化标志物:神经炎症
神经退行性病变的标志之一是神经炎症,神经炎症是小胶质细胞和星形胶质细胞等神经胶质细胞在患病或受损条件下发生反应的过程。至于这些细胞如何直接导致疾病,目前正在进行深入研究,SfN 报道了有关这一过程令人兴奋的大量新发现。很难对有关这个热门话题的数百张海报和演讲做出一个总结,但在“阿尔茨海默病:神经胶质细胞”这一特别会议中,则对神经胶质细胞如何在疾病状态下通过改变与神经元的接触来促进疾病病理进行了重点说明。
众所周知,小胶质细胞在发育过程中会消除多余的神经元突触,这一过程称为突触修剪。然而,尚不清楚的是,这个过程是否发生在疾病条件下,尤其是在发育性突触修剪停止之后。尽管研究人员推测胶质细胞可能直接参与了这一过程,但一直缺乏证据,尤其是在人体中。
展会上展示的两个独立小组的工作表明,人体 AD 中的突触丢失可能是通过神经胶质细胞发生的。来自英国痴呆症研究所的 Tara L. Spires-Jones 博士小组(由 M. Tzioras 讲述)以及马萨诸塞州总医院的 Teresa Gomez-Isla 博士(由 R.N.Taddei 讲述)检查了 AD 患者的死后脑组织。与未患病样本相比,使用共标记抗体染色技术标记人 AD 患者的小胶质细胞中突触蛋白(如突触蛋白 I)和胶质标记物(如 CD68 和 GFAP),两组均观察到突触点增加,这可能提示胶质细胞吸收突触碎片。
令人惊讶的是,Spires-Jones 博士的小组还观察到星形胶质细胞中的突触碎片,首次证明星形胶质细胞也可能导致与疾病相关的突触丢失。使用分离的原代人小胶质细胞和星形胶质细胞,Spires-Jones 博士能够将神经胶质细胞摄取突触与遗传风险因素相关联,并提出了 MFG-E8 依赖性吞噬机制。
Gomez-Isla 博士的研究小组观察到,在疾病状态下,小胶质细胞和星形胶质细胞对突触进行类似的吞噬作用,并提出了一种模型,认为星形胶质细胞在晚期病理标志物出现之前,就已经有效地介导了突触的去除。有趣的是,Gomez-Isla 博士使用了一种叫做扩展显微镜的新技术,通过扩展和物理放大要成像的组织,对诸如大脑等组织进行超分辨率成像。
扩展显微镜是一种新兴技术,可以发现 AD 中的关键细胞和分子机制见解。一如既往,我乐观地认为,新技术和新工具的发展将促进科学发现和进步。
研究阿尔茨海默病的新工具
今年有些许特殊,Cell Signaling Technology (CST) 发布了两张海报,展示了我们为更好地了解 AD 的细胞和分子贡献而开发的新工具。
海报:研究 TREM2 信号转导通路的抗体
在我的同事 Jordan Hirschfeld 展示的第一张海报中,我们开发了基于抗体的工具,这些工具可用于研究 TREM2 信号转导通路。TREM2 是一种在小胶质细胞中表达的受体蛋白,在遗传和机制上与 AD 相关。研究者正在针对 TREM2 进行治疗干预,但 TREM2 下游的信号转导级联尚未得到充分表征。
为了促进 TREM2 调节物的开发,我们通过筛选潜在的 TREM2 下游信号转导分子,建立了 TREM2 信号转导读数。我们使用先前描述的 TREM2 激活抗体,将磷酸化 Syk (pSyk) 确定为 TREM2 激活的可靠读数。为了识别我们自己的 TREM2 激活抗体,我们使用小胶质细胞样永生化人和小鼠细胞系,筛选了一个用于 pSyk 激活的靶向兔单克隆抗体的 TREM2 胞外域库(图 1)。
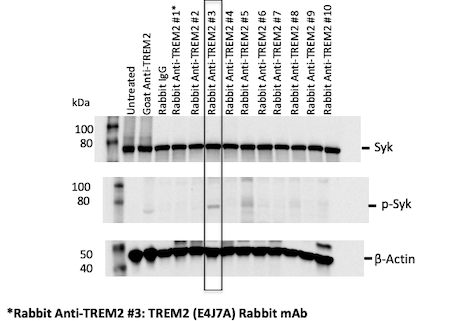 图 1:生成抗人 TREM2 重组单克隆抗体库,并使用 pSyk 作为读数筛选 TREM2 的体外刺激。
图 1:生成抗人 TREM2 重组单克隆抗体库,并使用 pSyk 作为读数筛选 TREM2 的体外刺激。
使用这种策略,我们鉴定了多种人和小鼠 TREM2 激活单克隆抗体。诸如读出和激活 TREM2 抗体这些工具的开发,将有助于促进针对这一重要的基于小胶质细胞的治疗性 AD 靶标的药物开发。
海报:表征小胶质细胞活化状态的抗体
小胶质细胞如何直接或间接促进 AD 的发生和发展?仍在对这一方面开展紧张的调查。基于在过去五年中开展的多项 RNA-seq 研究,可以明确在疾病背景下,小胶质细胞以不同的分子状态存在。然而,细胞的转录组学分析虽然很强大,但有其局限性。例如,RNA 图谱可能与最终驱动小胶质细胞功能的蛋白质表达不完全相关。此外,蛋白质表达的空间背景是理解小胶质细胞与疾病之间关系的重要因素。例如,与疾病相关的 RNA 靶标相关的翻译蛋白是否在小胶质细胞中同样上调?它们是否与 AD 中 β 淀粉样蛋白 (Aβ) 斑块等疾病病理标志的接近度有关?
为了研究这些问题,我们发布了第二张海报,标题为“开发新型兔单克隆抗体,以表征阿尔茨海默病鼠类模型中的小胶质细胞活化状态”,描述了一些基于抗体的工具,这些工具的开发目的在于对可标记疾病相关小胶质细胞的蛋白质进行染色。Cathepsin D 是一种参与蛋白质降解的溶酶体天冬氨酰蛋白酶,我们重点开发了一种针对 Cathepsin D 的特定抗体。在 AD 小鼠模型中,编码 Cathepsin D 的基因在小胶质细胞中上调。还有类似的情况,当使用 Cathepsin D 的抗体和多重免疫荧光策略对小胶质细胞进行染色时,我们观察到 Cathepsin D 阳性的小胶质细胞围绕淀粉样斑块,这表明这种新工具可用于标记可能直接导致阿尔茨海默病进展的反应性小胶质细胞(图 2)。
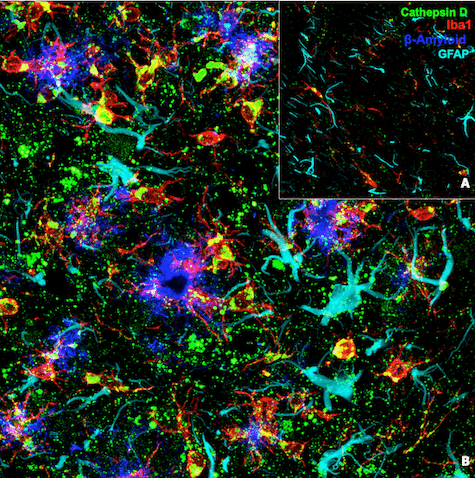
图 2:使用 Cathepsin D (E7Z4L) XP® Rabbit mAb #88239(绿色)、Iba1/AIF-1 (E4O4W) XP® Rabbit mAb (Alexa Fluor® 647 Conjugate) #78060(红色)、GFAP(青色)和 β-Amyloid(蓝色)对来自野生型小鼠 (A) 和 AD 淀粉样蛋白小鼠模型 (B) 的脑部进行共聚焦免疫荧光分析。
未来还有机会分析多个分子特征。此外,在检查可能与细胞功能相关的细胞形态方面,将来还会涌现出新技术。
对新见解、新技术和新工具的探索仍在继续
在过去将近三年的时间里,我们错过了几次重要会议,而现在我很高兴有机会见证在神经科学领域寻求新发现和新见解、采用新技术与新工具过程中的积极互动。现在,科学界比以往任何时候都联系得更加紧密,远远超出我们的想象。SfN 会议的特别之处在于它聚焦于大脑最具吸引力的方面 — 神经元网络(包括神经胶质细胞等非神经元细胞)如何协同工作以促进复杂的人类行为和疾病的发生?
我已经迫不及待地期盼 2023 年在华盛顿特区举行的下一次会议了,届时希望能在那里见到您!
其他资源:
- 下载神经退行性病变标志电子书
- 查看我们的 TREM2 信号转导通路
科学营销作家兼 CST 博客管理员 Alexandra Foley 对本文的撰写做出了贡献。








 沪公网安备31011502018823号
沪公网安备31011502018823号