癌细胞刺激血管生长,为肿瘤提供营养。血管生成是由先前存在的血管形成的新血管。这在肿瘤生长中起重要作用。

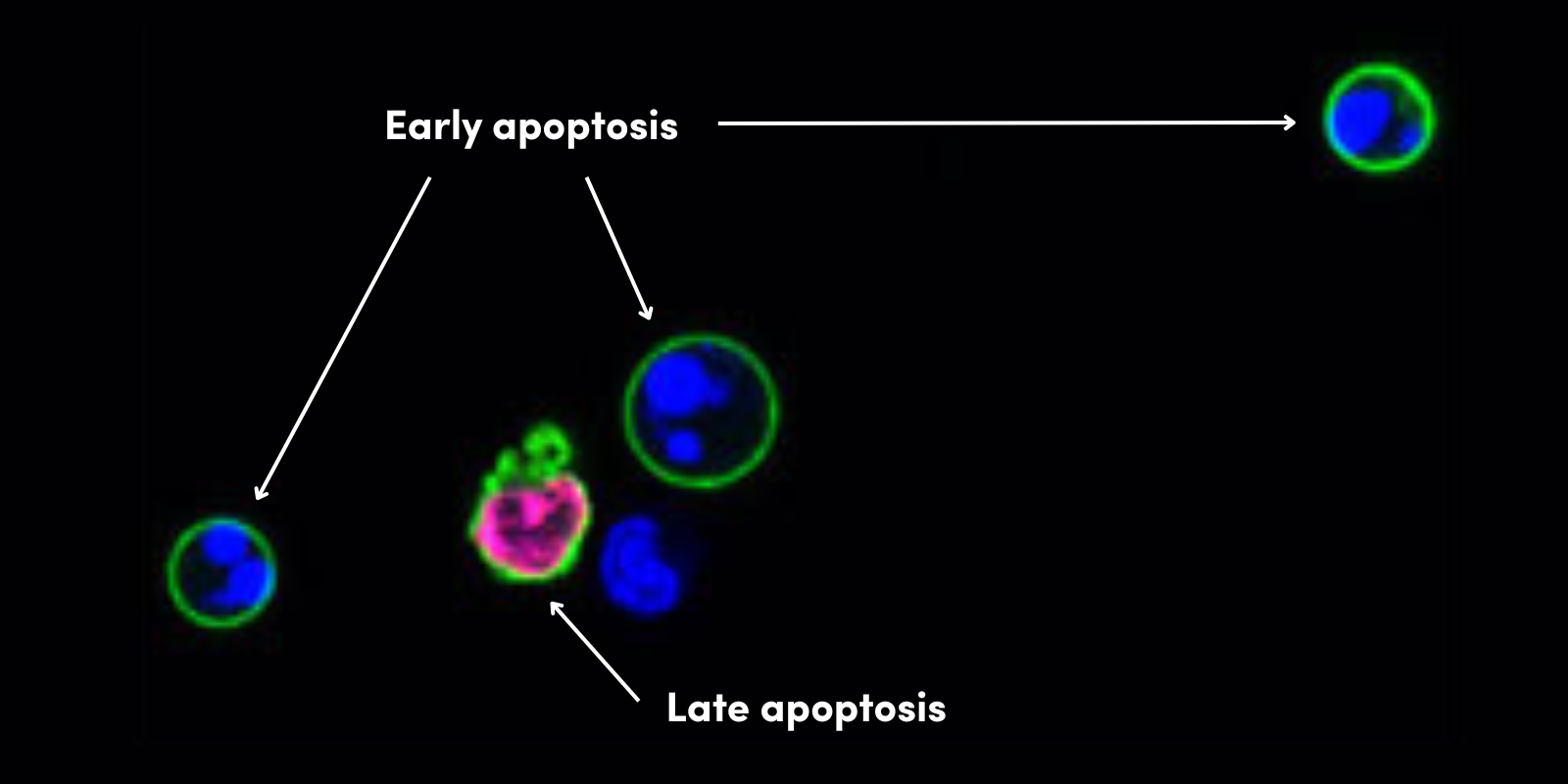
良性肿瘤存在于休眠状态下,难以获取足够血液供应时会受到影响。但当休眠肿瘤中血管生成被激活,以及分泌出的生长因子会诱导内皮细胞发芽和趋化成为肿瘤团块时,会出现“血管生成开关”。
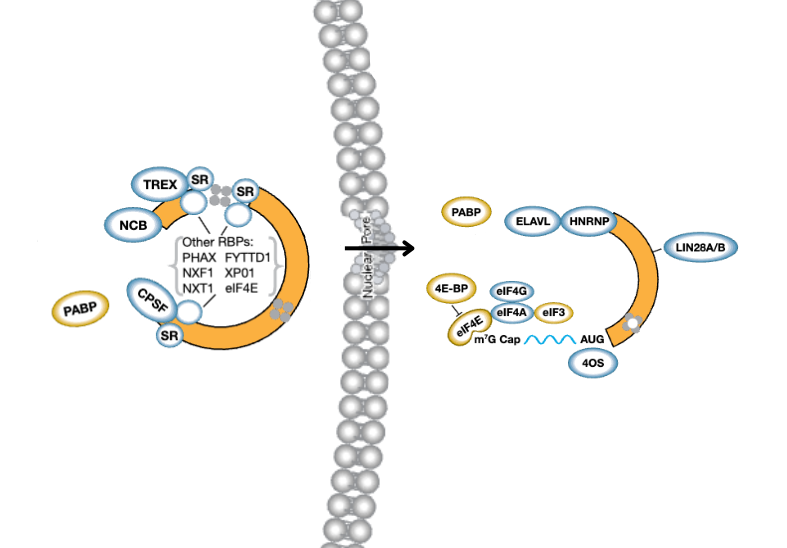
在肿瘤团块的低氧环境中,缺氧诱导因子-1 (HIF-1) 稳定并激活了促血管生成过程的多个基因的表达,包括血管内皮生长因子 (VEGF) 和成纤维细胞生长因子 (bFGF) 或血小板衍生生长因子 (PDGF)。
单击“血管生成通路”链接以了解有关此癌症标志中涉及的相关蛋白的更多信息:
- 血管生成通路
查看肿瘤研究靶标标志的完整指南。立即下载电子书。
Robert Weinberg 和 Douglas Hanahan 博士确定了癌症的标志,这些标志最初发表在《细胞》杂志1上。作者提出了这样的想法,即可以将癌症的复杂性分解为基本原理的较小子集。此处信息与其中一个这样的子集有关。本系列中的其他条目探讨了其他已知的标志。
阅读癌症标志系列中的其他博客文章,了解更多信息:
- Hanahan D, Weinberg RA (January 2000). "The Hallmarks of Cancer". Cell. 100 (1): 57–70. doi:10.1016/S0092-8674(00)81683-9
- Hanahan D, Weinberg RA (March 2011). "Hallmarks of Cancer: the next generation". Cell. 144 (5):646-74. doi: 10.1016/j.cell.2011.02.013.


 沪公网安备31011502018823号
沪公网安备31011502018823号